17.下列有关两种微粒ZAX和ZA+1X+的叙述正确的是( )
| A. | 一定都是由质子、中子、电子组成的 | |
| B. | 化学性质几乎完全相同 | |
| C. | 核电荷数和核外电子数一定相等 | |
| D. | 质子数一定相同,质量数和中子数一定不相同 |
16.如图有关原子或离子的结构示意图表示正确的是( )
| A. | 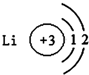 | B. | 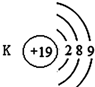 | C. | 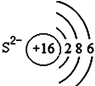 | D. | 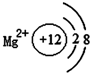 |
15.根据原子结构的相关知识可知,不同种元素的本质区别是( )
| A. | 质子数不同 | B. | 中子数不同 | C. | 电子数不同 | D. | 质量数不同 |
12.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol•L-1 FeCl2溶液,实验记录如表(a、b、c代表电压值):
(1)用KSCN溶液检验出溶液中含Fe3+,看到的现象是溶液变红.
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
①NaCl溶液的浓度应是0.2 mol•L-1.
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
9.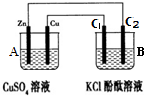 思考下列问题,按要求填空:
思考下列问题,按要求填空:
(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
(4)如图所示,装置B中两电极均为石墨电极,试回答下列问题:
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.
0 168246 168254 168260 168264 168270 168272 168276 168282 168284 168290 168296 168300 168302 168306 168312 168314 168320 168324 168326 168330 168332 168336 168338 168340 168341 168342 168344 168345 168346 168348 168350 168354 168356 168360 168362 168366 168372 168374 168380 168384 168386 168390 168396 168402 168404 168410 168414 168416 168422 168426 168432 168440 203614
 思考下列问题,按要求填空:
思考下列问题,按要求填空:(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | 减小 | 减小 | 增大 |
| 平衡移动方向 | 逆向 | 正向 | 逆向 |
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.





 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题: