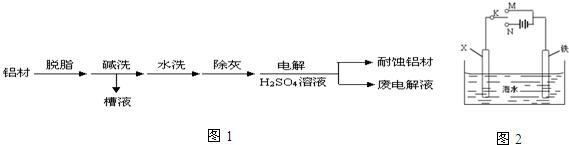
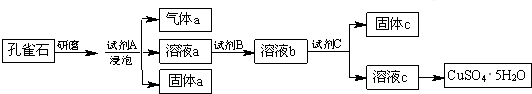
题目内容
16.如图有关原子或离子的结构示意图表示正确的是( )| A. | 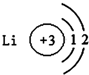 | B. | 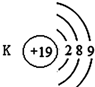 | C. | 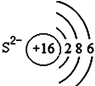 | D. | 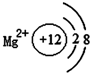 |
分析 A、原子核外电子排布先从最低能级排起,最内层最多容纳2个电子;
B、原子核外电子排布最外层不超过8个电子;
C、硫离子为硫原子得到2个电子形成的阴离子,最外层满足8个电子的稳定结构;
D、镁离子为镁原子失去最外层2个电子形成的阳离子,据此解答即可.
解答 解:A、Li的原子结构示意图正确的是: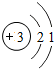 ,故A错误;
,故A错误;
B、K的原子结构示意图为 ,故B错误;
,故B错误;
C、硫离子的结构示意图为: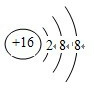 ,故C错误;
,故C错误;
D、镁离子的结构示意图为: ,故D正确,
,故D正确,
故选D.
点评 本题考查学生原子结构示意图的意义,注意原子中存在的等式关系:核内质子数=核外电子数=原子序数是关键,难度不大.

练习册系列答案
相关题目
6.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染.其电池反应为:2Zn+O2=2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为:Zn-2e-=Zn2+ | ||
| C. | 正极发生氧化反应 | D. | 正极反应为:Zn-2e-=Zn2+ |
7.工业制硫酸中的一步重要反应是SO2在400~600℃下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 无论怎样控制反应条件,2 mol SO2与1 mol O2 反应时都不会生成2 mol SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
4.甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流.关于此燃料电池的下列叙述正确的是( )
| A. | 通入CH4 的电极为正极 | |
| B. | 正极的电极反应式为:2O2+8e-+4H2O═8OH- | |
| C. | 若甲烷通入量为1.12 L(标准状况)且反应完全,则电池中有0.1 mol O2 被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+2O2+4e-═CO2+2H2O |
1.在一定温度下,向2L密闭容器中加入1mol X和2mol Y,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 单位时间内消耗0.1mol X,同时生成0.2mol Y | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
8.下列实验操作正确的是( )
| A. | 测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润 | |
| B. | 容量瓶用蒸馏水洗净、必须烘干后才能用于溶液的配制 | |
| C. | 用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出 | |
| D. | 中和滴定时,锥形瓶不需要用待测液润洗后就能使用 |
6.下列有关物质用途的叙述中,不正确的是( )
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | SiO2常用于制造光导纤维 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |