18.下列化合物中的化学键中,既有离子键又有共价键的是( )
| A. | H2O | B. | NaCl | C. | NH4Cl | D. | HCl |
17.下列化合物中,属于原子晶体的是( )
| A. | CO2 | B. | NaOH | C. | SiO2 | D. | Si |
16.下列有机物属于烃的是( )
| A. | CH3Cl | B. | C6H6 | C. | C6H12O6 | D. | CH3CHO |
15.2011年3月日本福岛大地震引起的核泄漏污染物中包含${\;}_{53}^{131}$I等放射性同位素.下列有关${\;}_{53}^{131}$I的说法中,正确的是( )
| A. | 质子数为53 | B. | 中子数为53 | C. | 质子数为131 | D. | 中子数为131 |
13.X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.M是地壳中含量最高的金属元素.下列说法正确的是( )
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 | |
| C. | 用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和2:1的化合物 |
12.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成42.0L N2(标准状况) | |
| B. | 有0.250mol KNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.0mol |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下1L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L |
10.常温下,下列溶液中的离子浓度关系一定正确的是( )
| A. | PH=11的Na2SO3溶液中,水的电离c( H+)=1.0×10-11mol/L | |
| B. | PH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c( OH-)=1.0×10-6mol/L | |
| C. | PH=4的NaHC2O4溶液中存在:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-) | |
| D. | PH=2的硝酸与PH=12的氨水等体积混合c( NO3-)>c( NH4+)>c( H+)>c( OH-) |
9.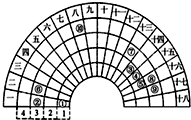 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
0 168238 168246 168252 168256 168262 168264 168268 168274 168276 168282 168288 168292 168294 168298 168304 168306 168312 168316 168318 168322 168324 168328 168330 168332 168333 168334 168336 168337 168338 168340 168342 168346 168348 168352 168354 168358 168364 168366 168372 168376 168378 168382 168388 168394 168396 168402 168406 168408 168414 168418 168424 168432 203614
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | 对应简单离子半径②>⑧>⑨ | |
| B. | 简单氢化物稳定性⑤>⑧ | |
| C. | 最高价氧化物对应的水化物酸性⑨>⑧>⑦ | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
