题目内容
9. 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | 对应简单离子半径②>⑧>⑨ | |
| B. | 简单氢化物稳定性⑤>⑧ | |
| C. | 最高价氧化物对应的水化物酸性⑨>⑧>⑦ | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
分析 由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性越强,氢化物越稳定;
C.非金属性越强,最高价氧化物对应的水化物酸性越强;
D.H分别与C、N、O可以形成CH≡CH、N2H4、H2O2.
解答 解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故A错误;
B.非金属性O>S,简单氢化物稳定性⑤>⑧,故B正确;
C.非金属性Cl>S>Al,最高价氧化物对应的水化物酸性⑨>⑧>⑦,故C正确;
D.H分别与C、N、O可以形成CH≡CH、N2H4、H2O2,极性键又含非极性键,故D正确.
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握扇形元素周期表与常见元素周期表的关系为解答的关键,注意非金属性的比较及化合物中的化学键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.含甲醛0.15g的水溶液,跟足量的银氨溶液共热时,最多可生成银的质量是( )
| A. | 0.54g | B. | 1.08g | C. | 1.62g | D. | 2.16g |
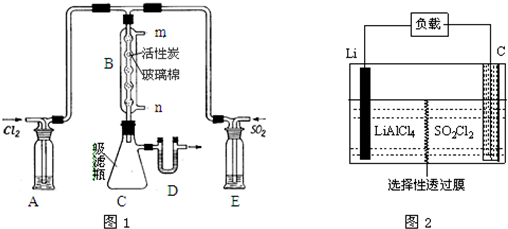
17.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 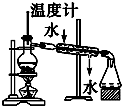 用图分离两种互溶但沸点相差较大的液体混合物 | |
| B. | 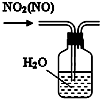 用图所示装置可除去NO2中的NO | |
| C. | 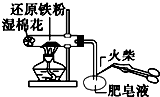 用图检验铁粉与水蒸气反应产生的氢气 | |
| D. | 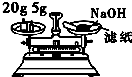 用图称量氢氧化钠固体 |
4.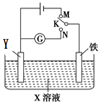 利用如图所示装置进行下列实验,下表中对应叙述正确的是( )
利用如图所示装置进行下列实验,下表中对应叙述正确的是( )
 利用如图所示装置进行下列实验,下表中对应叙述正确的是( )
利用如图所示装置进行下列实验,下表中对应叙述正确的是( )| A | X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 | 一段时间后溶液的pH均增大 |
| B | X为氯化钠,Y为石墨 K与M连接时; K与N连接时 | 石墨电极反应均为: 4OH--4e-═2H2O+O2↑ |
| C | X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 | 铁电极反应均为: 2H++2e-═H2↑ |
| D | X为氯化钠,Y为锌 K与M连接时; K与N连接时 | 铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
1.下列物质属于同分异构体的一组是( )
| A. | 淀粉和纤维素 | B. | C2H6与C3H8 | ||
| C. | O2与O3 | D. | CH3-CH2-CH2-CH3 与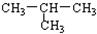 |
18.向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |
19.下列事实中能说明醋酸是弱电解质的是( )
| A. | 用醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1 mol?L-1醋酸溶液的c(H+)约为0.004 mol•L-1 |
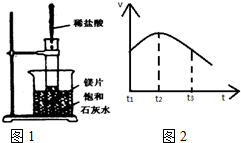 氢气是新能源家族的重要成员,请解决下列与氢气相关的问题.
氢气是新能源家族的重要成员,请解决下列与氢气相关的问题.