3.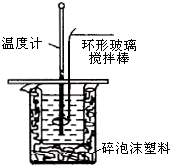 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
(5)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ,原因是浓硫酸溶于水放出热量.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
1.常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是( )
| A. | V≥$\frac{1}{18}$ | B. | V≤$\frac{1}{23}$ | C. | V<$\frac{1}{18}$ | D. | V≤$\frac{1}{56}$ |
20.已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中不正确的是( )
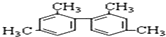

| A. | 等质量的该烃和甲烷均完全燃烧,耗氧量前者小于后者 | |
| B. | 该烃能使酸性高锰酸钾溶液褪色,属于苯的同系物 | |
| C. | 分子中一定有11个碳原子处于同一平面上 | |
| D. | 该烃的一氯取代产物为5种 |
19.下列说法正确的是( )
| A. | 溶液、胶体、浊液三种分散系可用丁达尔效应进行区分 | |
| B. | △H<0且△S>0的反应可以自发进行 | |
| C. | 酸碱中和滴定实验中装标准液的滴定管未润洗,会造成所测结果偏低 | |
| D. | 钢铁吸氧腐蚀的负极反应为:O2+4e-+2H2O═4OH- |
18.有A、B、C、D四种原子序数依次增大的短周期元素,其中只有C为金属元素,A和C的最外层电子数相同,C和D的质子数之和是A和B质子数之和的3倍,D的氧化物是形成酸雨的主要气体,下列说法不正确的是( )
| A. | B和C可形成一种含不同类型的化学键的碱性氧化物 | |
| B. | D2-离子在水溶液中与Al3+、H+均不能大量共存 | |
| C. | A2B的稳定性强于A2D的稳定性 | |
| D. | A2D和DB2可发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为2:1 |
15.如表实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br与NaOH溶液是否发生反应 | 将CH3CH2Br与NaOH溶液共热,冷却,取上层溶液,加AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 将打磨过的Al片投到一定浓度的CuCl2溶液,出现气泡并有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解 | Al与CuCl2溶液反应,有H2和Cu(OH)2生成 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验乙醇与浓硫酸共热是否产生乙烯 | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关说法正确的是( )
0 168216 168224 168230 168234 168240 168242 168246 168252 168254 168260 168266 168270 168272 168276 168282 168284 168290 168294 168296 168300 168302 168306 168308 168310 168311 168312 168314 168315 168316 168318 168320 168324 168326 168330 168332 168336 168342 168344 168350 168354 168356 168360 168366 168372 168374 168380 168384 168386 168392 168396 168402 168410 203614
| A. | 反应2Mg(s)+CO2(g)═2MgO(s)+C(s)能自发进行,则该反应的△H<0 | |
| B. | 铅蓄电池放电时反应为:PbO2+Pb+2H2SO4═2PbSO4+H2O,正、负极质量均减小 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,充分搅拌后过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
 .
.