3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
1.电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板蚀刻液.某探究小组设计如下线路处理废液和资源回收:
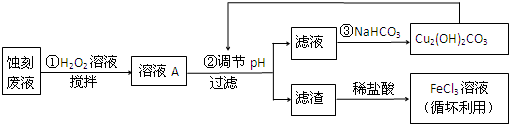
请回答:
(1)FeCl3-HCl溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+、Fe2+和Cu2+.
(2)FeCl3蚀刻液中加入盐酸的目的:可以抑制氯化铁水解,又可提高蚀刻速率.
(3)步骤①中加入H2O2溶液的目的是因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
(4)已知:
生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是3.2≤pH<4.7.
(5)写出步骤②中生成CO2的一个离子方程式4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3不易溶于水).
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+H2O+3 CO2↑.

请回答:
(1)FeCl3-HCl溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+、Fe2+和Cu2+.
(2)FeCl3蚀刻液中加入盐酸的目的:可以抑制氯化铁水解,又可提高蚀刻速率.
(3)步骤①中加入H2O2溶液的目的是因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
(4)已知:
生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)写出步骤②中生成CO2的一个离子方程式4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3不易溶于水).
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+H2O+3 CO2↑.
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中( )


| A. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol•L-1 | |
| B. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| C. | SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在 | |
| D. | 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
8.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
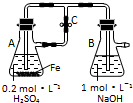

| A. | 用如图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
7.某药物中间体X的结构如图所示,下列说法正确的是( )


| A. | 该X的分子式为C23H25N2O3 | |
| B. | 每个X分子中含有2个手性碳原子 | |
| C. | 1 mol X最多能与9 mol H2发生加成反应 | |
| D. | X能发生水解、氧化和消去反应 |
6.下列有关说法正确的是( )
0 168202 168210 168216 168220 168226 168228 168232 168238 168240 168246 168252 168256 168258 168262 168268 168270 168276 168280 168282 168286 168288 168292 168294 168296 168297 168298 168300 168301 168302 168304 168306 168310 168312 168316 168318 168322 168328 168330 168336 168340 168342 168346 168352 168358 168360 168366 168370 168372 168378 168382 168388 168396 203614
| A. | 为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量等于0.573 kJ |

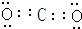 ,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).
,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).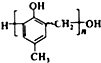 ,化合物C和化合物N的合成路线如下:
,化合物C和化合物N的合成路线如下:
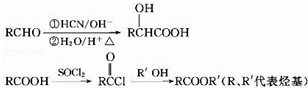
 ,D的含氧官能团的名称是羧基.
,D的含氧官能团的名称是羧基.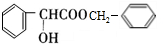 .
.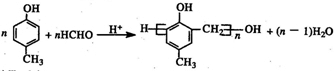 .
. .
.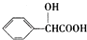 )有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式
)有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式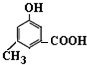 .
.
 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.
翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.