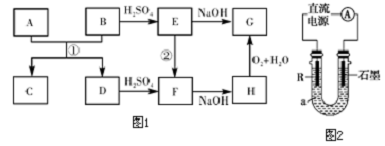
15.石墨烯的结构示意图如图所示,下列说法正确的是( )

| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
14.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成; 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应 |
12.现有部分短周期元素相关信息如下表所示:
(1)四种元素原子半径由大到小的顺序为Y>Z>X>T(用T、X、Y、Z表示).M中所含化学键的类型为离子键、共价键.
(2)若Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则R与M反应的离子方程式为SiO2+2OH-=SiO32-+H2O.若Z能形成稳定的单核离子,则请举例说明Z的金属性比Y的金属性弱:NaOH的碱性比Al(OH)3强.
(3)元素T与氢元素可形成原子个数比为1:1的化合物Q,元素X与氢元素可形成原子个数比为1:2的化合物W,W常用作发射火箭的燃料,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=N2↑+4H2O.
| 元素 | T | X | Y | Z |
| 信息 | 原子最外层电子数比内层电子数多4 | 最高正价为+5,单质性质很稳定 | L层电子数比其他电子层电子数之和多5 | 单质、最高价氧化物(R)及对应的水化物均可与Y的最高价氧化物对应的水化物(M)反应 |
(2)若Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则R与M反应的离子方程式为SiO2+2OH-=SiO32-+H2O.若Z能形成稳定的单核离子,则请举例说明Z的金属性比Y的金属性弱:NaOH的碱性比Al(OH)3强.
(3)元素T与氢元素可形成原子个数比为1:1的化合物Q,元素X与氢元素可形成原子个数比为1:2的化合物W,W常用作发射火箭的燃料,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=N2↑+4H2O.
6.运用化学反应原理分析解答以下问题.
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
①当弱酸的浓度一定时,升高温度,K值变大(填“变大”、“变小”或“不变”).
②下列离子方程式和有关说法错误的是ad
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-=2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
d.相同温度时,等物质的量三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3)>V(H2SO3)>V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4,该反应的氧化产物是H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若改变条件使上述平衡向正反应方向移动,则下列说法正确的是ac
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH?(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)
②2CH3OH(g)?CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)?CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g) 的化学平衡常数K=a12•a2•a3L4•mol-4(用含a1、a2、a3的代数式表示).
向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的$\frac{2}{3}$,则CO的转化率50%.
0 168196 168204 168210 168214 168220 168222 168226 168232 168234 168240 168246 168250 168252 168256 168262 168264 168270 168274 168276 168280 168282 168286 168288 168290 168291 168292 168294 168295 168296 168298 168300 168304 168306 168310 168312 168316 168322 168324 168330 168334 168336 168340 168346 168352 168354 168360 168364 168366 168372 168376 168382 168390 203614
(1)弱酸在水溶液中存在电离平衡,部分0.1mol•L-1弱酸的电离平衡常数如下表:
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
②下列离子方程式和有关说法错误的是ad
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2=2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-=2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
d.相同温度时,等物质的量三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3)>V(H2SO3)>V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性.往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:H2SeO3+2SO2+H2O=Se↓+2H2SO4,该反应的氧化产物是H2SO4.
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放.
①在废水中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若改变条件使上述平衡向正反应方向移动,则下列说法正确的是ac
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH?(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol•L-1,溶液的pH调至4时,没有(填“有”或“没有”)沉淀产生.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)
②2CH3OH(g)?CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)?CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g) 的化学平衡常数K=a12•a2•a3L4•mol-4(用含a1、a2、a3的代数式表示).
向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的$\frac{2}{3}$,则CO的转化率50%.
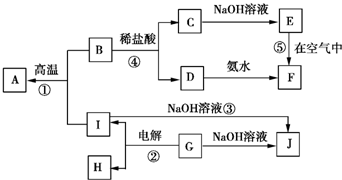 A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素.
A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素.
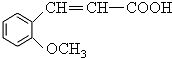 .
. 、
、 或
或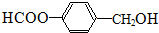 (任写一种).
(任写一种).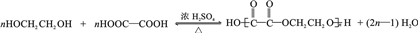 .
. 为原料制
为原料制 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2: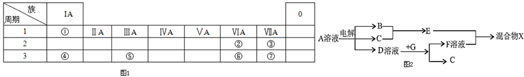
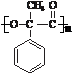
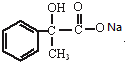
 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:

 .
. .
.