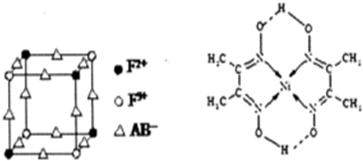
15.化学与生化、社会密切相关,下列说法不正确的是( )
| A. | 维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高 | |
| B. | 2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求 | |
| C. | 稀的双氧水可用于清洗伤口,以达到杀菌、消毒的目的 | |
| D. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
14.下列反应的离子方程式书写正确的是( )
| A. | 二氧化硫通入溴水使其褪色 SO2+Br2+2H2O═4H++2Br-+SO32- | |
| B. | 石灰石与稀盐酸 CO32-+2H+═H2O+CO2↑ | |
| C. | 小苏打溶液中滴加醋酸溶液 HCO3-+CH3COOH=CH3COO-+H2O+CO2↑ | |
| D. | 氯化铝溶液中加入过量的氨水 Al3++4 NH3•H2O=4NH4++AlO2-+2H2O |
12.下列有关实验现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
11.在室温下,下列各组微粒在溶液中能大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
10.下列说法正确的是( )
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| B. | 棉、丝、羽毛、塑料及合成橡胶完全燃烧都只生成CO2和H2O | |
| C. | 纤维素、合成纤维、光导纤维都是有机高分子化合物 | |
| D. | 液化石油气可由石油分馏获得,汽油可由石油分馏或石油裂化获得 |
6.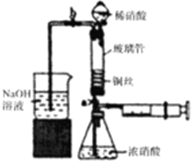 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
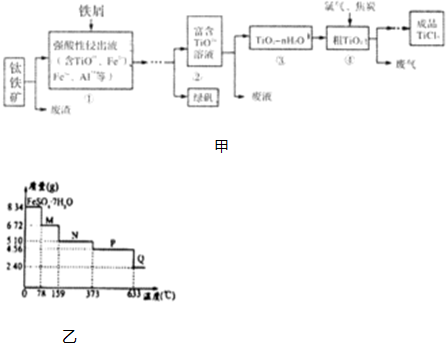
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
①根据上表得出的结论是温度越低(填“高”或“低”),进入试管中的溶液越多;
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
0 168184 168192 168198 168202 168208 168210 168214 168220 168222 168228 168234 168238 168240 168244 168250 168252 168258 168262 168264 168268 168270 168274 168276 168278 168279 168280 168282 168283 168284 168286 168288 168292 168294 168298 168300 168304 168310 168312 168318 168322 168324 168328 168334 168340 168342 168348 168352 168354 168360 168364 168370 168378 203614
 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
 .
.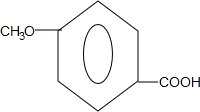 .
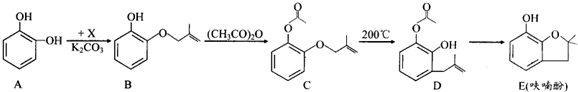
.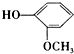 和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.
和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.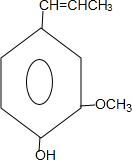 +CH3OCOCOCH3→
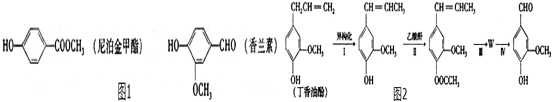
+CH3OCOCOCH3→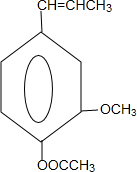 +CH3COOH.
+CH3COOH. _.
_.
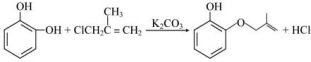 ;
;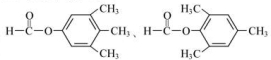 ;
; ;
;