5.软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制高纯度的硫酸锰晶体,其流程如图所示:
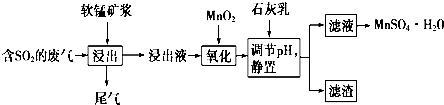
已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如右表所示:
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-
(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
(4)从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
(5)下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(6)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此 观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(7)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶;过滤.利用 废渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.

已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如右表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-
(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
(4)从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
(5)下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(6)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此 观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(7)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶;过滤.利用 废渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
3.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图1:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
1.某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+3H2O.
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).
14.下列化学用语的表达正确的是( )
| A. | Na2SO4电离:Na2SO4=Na2++SO42- | |
| B. | 氯化钠的分子式:NaCl | |
| C. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C | |
| D. | 医用“钡餐”的化学式:BaSO4 |
13.下列各式能真实表示物质分子组成的是( )
| A. | SO2 | B. | CaCl2 | C. | SiO2 | D. | Na2O2 |
12.下列物质中含有共价键的离子化合物是( )
| A. | BaCl2 | B. | AlCl3 | C. | HCl | D. | Na2O2 |
10.第三周期R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是( )
0 168181 168189 168195 168199 168205 168207 168211 168217 168219 168225 168231 168235 168237 168241 168247 168249 168255 168259 168261 168265 168267 168271 168273 168275 168276 168277 168279 168280 168281 168283 168285 168289 168291 168295 168297 168301 168307 168309 168315 168319 168321 168325 168331 168337 168339 168345 168349 168351 168357 168361 168367 168375 203614
| A. | Li | B. | S | C. | Si | D. | P |


 .
. .
.