题目内容
10.第三周期R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是( )| A. | Li | B. | S | C. | Si | D. | P |
分析 第三周期R元素的原子的次外层的电子数为最外层电子数的2倍,最外层不大于8个电子,次外层不大于18个电子,以此进行判断.
解答 解:A.Li原子核外各层电子分别为2、1,次外层的电子数为最外层电子数的2倍,但属于第二周期,故A错误;
B.S原子核外各层电子分别为2、8、6,次外层的电子数不为最外层电子数的2倍,故B错误;
C.Si原子核外各层电子分别为2、8、4,次外层的电子数为最外层电子数的2倍,属于第三周期,故C正确;
D.P原子核外各层电子分别为2、8、5,次外层的电子数不为最外层电子数的2倍,故D错误.
故选C.
点评 本题考查了原子核外电子的排布,难度不大,注意原子核外电子的排布时,每个电子层上最多排2n2个电子,但必须遵循“最外层不大于8个电子,次外层不大于18个电子,”的规则.

练习册系列答案
相关题目
5.元素X和Y的原子序数都小于18,两者能组成化合物XY3.已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+3 | B. | n-4 | C. | n-6 | D. | n-8 |
1.某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+3H2O.
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).
8.由下列实验所得结论或解释正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有沉淀产生 | 蛋白质均发生变性 |
| D | 向某溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
5.如图为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素,下列说法正确的是( )
| X | ||
| Y | Z | R |
| W |
| A. | Z的氧化物与X单质不可能发生置换反应 | |
| B. | 五种元素的原子最外层电子数一定都大于2 | |
| C. | X、Z原子序数可能相差18 | |
| D. | Z可能是氯元素 |
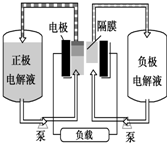 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.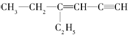 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8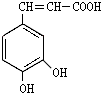 ),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
.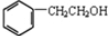 ,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为
,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为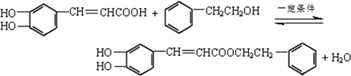 .
.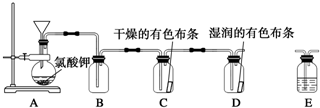
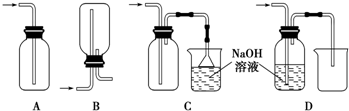
 .
.