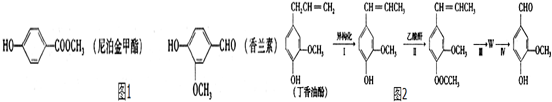
题目内容
4.硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验(已知25℃氢氧化镁Ksp=5.6×10-12;氢氧化铁Ksp=3.5×10-38;一水合氨电离常数K=1.8×10-5,其饱和溶液中c (OH-) 约为1×10-3mol•L-1).
请回答:
(1)写出固体E的化学式:Mg(OH)2.
(2)试剂①是A
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液H中溶质的化学式:NaCl、NaHCO3
(4)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是CD
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(5)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操灼烧.
(6)若不考虑溶液体积的变化,请计算溶液F中c(Mg2+)=5.6×10-10mol•L-1.
分析 硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝,
(1)固体E是氢氧化镁;
(2)试剂①是强碱溶液;
(3)溶液F的溶质含有偏铝酸钠和氯化钠,通入过量的二氧化碳生碳酸氢钠溶液;
(4)pH值精确到小数点后一位,测定较准确;
(5)难溶性碱加热分解;
(6)根据氢氧化镁Ksp=5.6×10-12来计算.
解答 解:I.根据硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝,
(1)固体E是氢氧化镁,故答案为:Mg(OH)2;
(2)试剂①是强碱溶液,故选:A;
(3)溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,故答案为:NaCl、NaHCO3;
(4)因PH值精确到小数点后一位,而石蕊试液测得的PH值在一个范围内,广泛pH试纸测得的PH值是一个整数,精密pH试纸、pH计均可准确到小数点后一位,故选:CD;
(5)固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,故答案为:灼烧;
(6)因溶液的pH值为13,c(OH-)=10-1mol•L-1,Ksp=c(Mg2+)×c2(OH-)=c(Mg2+)×10-2=5.6×10-12,所以c(Mg2+)=5.6×10-10 mol•L-1,故答案为:5.6×10-10 mol•L-1.
点评 本题考查了物质的分离、提纯的方法选择及应用,实验方案设计和评价,题目难度较大,明确各物质的性质是解本题的关键,本题注意溶度积的相关计算.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2A12O3 $\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ | ||
| C. | H2+Na2O $\frac{\underline{\;高温\;}}{\;}$2Na+H2O | D. | 4 CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:MgO>NaCl>KCl | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
| A. | SO2 | B. | CaCl2 | C. | SiO2 | D. | Na2O2 |
| A. | 向溴水中滴入植物油,振荡后油层仍显无色,因此溴不溶于油脂 | |
| B. | FeCl3溶液可以腐蚀线路板上的Cu,因此Fe的金属活动性大于Cu | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g),因此该反应△H<0 | |
| D. | 相同浓度的Na2CO3溶液的碱性强于C6H5ONa,因此C6H5OH的酸性强于H2CO3 |
| A. | 第9列元素中没有非金属元素 | |
| B. | 第17列为卤族元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
| A. | 向废液中加入少量的葡萄糖溶液,无红色沉淀产生,说明废液中不含Cu2+ | |
| B. | 向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl- | |
| C. | 向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+ | |
| D. | 向废液中滴加KSCN溶液,无现象,再加入氯水后溶呈血红色,说明废液中含有Fe2+ |
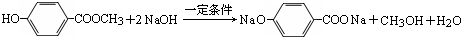 .
.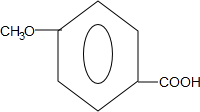 .
. 和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.
和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.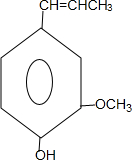 +CH3OCOCOCH3→
+CH3OCOCOCH3→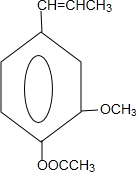 +CH3COOH.
+CH3COOH.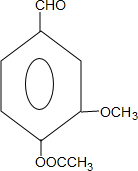 _.
_.