题目内容
2.用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如图1.已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物.请回答下列有关问题: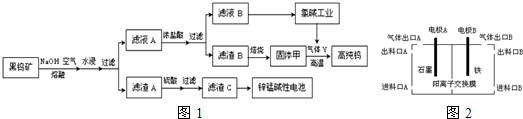
(1)上述流程中通入空气的目的是氧化Fe2+、Mn2+;
(2)滤渣A为黑色,其与硫酸反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
滤液A与浓盐酸反应的离子方程式为WO42-+2H+=H2WO4↓;
(3)实验室用锌锰碱性电池做电源模拟氯碱工业的装置如图2:
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,写出锌锰碱性电池正极反应式MnO2+e-+H2O=MnOOH+OH-;则锌锰碱性电池的锌电极应与装置中电极B(填“A”或“B”)相接,进料口A的物质为精制饱和食盐水,若锌电极消耗6.5g时产生的气体Y理论上能还原固体甲得到6.1g纯钨(保留一位小数).[Mr(W)=184]
(4)已知单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因会引入杂质碳,会生成碳化钨;
(5)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为2000mol/L.(溶液混合体积变化可忽略)
分析 黑钨矿通入空气与氢氧化钠在熔融状态下反应生成MnO2、Fe3O4、Na2WO4,加水溶解、过滤,滤渣A为黑色,含有MnO2、Fe3O4,加入硫酸,Fe3O4溶解,滤渣C为MnO2,可用于锌锰碱性电池,滤液A含有Na2WO4,加入盐酸可生成H2WO4沉淀,灼烧生成WO3,滤液B含有NaCl,电解饱和食盐水生成氢气,可与WO3反应生成W,
(1)上述流程中通入空气可氧化Fe2+、Mn2+;
(2)滤渣A含有MnO2、Fe3O4,加入硫酸,Fe3O4溶解;滤液A中含有WO42-,与氢离子反应生成H2WO4沉淀;
(3)锌锰碱性电池的正极上二氧化锰得电子生成MnOOH;电解饱和食盐水,石墨为阳极,铁为阴极,锌锰碱性电池的锌电极应与装置中电极B相连,氢气在阴极生成,从出口B出来,且阴极生成氢氧化钠,从进料口A加入的物质为精制饱和食盐水;根据电子守恒计算;
(4)单质碳也可与固体WO3制得钨,但易引入杂质碳;
(5)根据Ksp(FeWO4)=c(Fe2+)•c(WO42-)=2.5×10-12,结合亚铁离子的浓度计算即可.
解答 解:黑钨矿通入空气与氢氧化钠在熔融状态下反应生成MnO2、Fe2O3、Fe3O4、Na2WO4,加水溶解、过滤,滤渣A含有MnO2、Fe3O4,加入硫酸,Fe3O4溶解,滤渣C为MnO2,可用于锌锰碱性电池,滤液A含有Na2WO4,加入盐酸可生成H2WO4沉淀,灼烧生成WO3,滤液B含有NaCl,电解饱和食盐水生成氢气,可用于高温下与WO3反应生成W,
(1)上述流程中通入空气可氧化Fe2+、Mn2+,故答案为:氧化Fe2+、Mn2+;
(2)滤渣A含有MnO2、Fe3O4,加入硫酸,Fe3O4溶解,反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2+4H2O;滤液A中含有WO42-,与氢离子反应生成H2WO4沉淀,反应的离子方程式为:WO42-+2H+=H2WO4↓;
故答案为:Fe3O4+8H+=2Fe3++Fe2+4H2O;WO42-+2H+=H2WO4↓;
(3)锌锰碱性电池的正极上二氧化锰得电子生成MnOOH,则电池正极反应式为MnO2+e-+H2O=MnOOH+OH-,电解饱和食盐水,石墨为阳极,铁为阴极,锌锰碱性电池的锌电极应与装置中电极B相连,氢气在阴极生成,从出口B出来,且阴极生成氢氧化钠;从进料口A加入的物质为精制饱和食盐水,
根据电子守恒可知,Zn~2e-~H2~$\frac{1}{3}$WO3 ~$\frac{1}{3}$W
65 $\frac{1}{3}$×184
6.5g m(W)
则m(W)=$\frac{6.5g×\frac{1}{3}×184}{65}$=6.1g,
故答案为:MnO2+e-+H2O=MnOOH+OH-;B;精制饱和食盐水;6.1;
(4)单质碳也可与固体WO3制得钨,但易引入杂质碳,且生成碳化钨,故答案为:会引入杂质碳,会生成碳化钨;
(5)根据Ksp(FeWO4)=c(Fe2+)•c(WO42-)=2.5×10-12,Ksp(MnWO4)=7.5×10-16,体积为1L含MnWO4物质的量为0.6mol,则溶液中c(WO42-)=$\frac{7.5×1{0}^{-16}}{0.6}$=1.25×10-15,c(Fe2+)=$\frac{Ksp}{c(W{{O}_{4}}^{2-})}$=$\frac{2.5×1{0}^{-12}}{1.25×1{0}^{-15}}$=2000mol/L,
故答案为:2000.
点评 本题主要考查工业制备流程、金属的冶炼、化学计算,为高考高频考点,侧重于学生的分析能力和实验能力、计算能力的考查,综合性强,注意把握实验的流程和原理,难度中等.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| A. | 两种不同的元素不可能既在同一周期,又在同一主族 | |
| B. | 元素周期表中的元素不全是从自然界中发现的 | |
| C. | 周期表中共1-20号元素,含有非金属11种 | |
| D. | 若周期表中第8周期完全填满,此周期应含有有50种元素 |
| A. | 取代、加成、水解 | B. | 消去、加成、取代 | C. | 水解、消去、加成 | D. | 消去、水解、取代 |
| A. | 除去瓷器表面污垢可以选用热的烧碱溶液 | |
| B. | 溶质质量分数:医用酒精>食醋>生理盐水 | |
| C. | 绚丽缤纷的烟花是因添加了钾、钠、钙、铜等金属元素的焰色反应形成的 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
| A. | 电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变 | |
| B. | NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强 | |
| C. | SO3(g)+H2O(l)═H2SO4(aq)在常温下能自发进行,则该反应的△H<0 | |
| D. | 0.1 mo1•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值减小 |
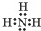 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键. .
.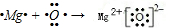 .
.