19.“原子结构模型”是科学家根据自己的认识,对原子结构的形象描摹,一种模型代表了人类某一阶段对原子结构的认识.人们对原子结构的描摹,按现代向过去顺序排列为:电子云模型、玻尔原子模型、卢瑟福原子模型、 原子模型、 原子模型.则横线内两位化学家是( )
| A. | 阿伏加德罗、汤姆生 | B. | 道尔顿、拉瓦锡 | ||
| C. | 舍勒、普利斯特里 | D. | 汤姆生、道尔顿 |
17.利用原电池原理可以探究金属的活动性.
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
15.为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:
(1)请在下表中填写与实验步骤对应的实验现象序号:
(2)写出钠与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(3)该实验得出的结论是Na、Mg、Al的金属活动性顺序由强到弱.
(4)用原子结构理论解释上述实验结论:同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小(填“增大”或“减小”),原子核对核外电子的引力逐渐增强,失电子能力逐渐减弱(填“增强”或“减弱”),因此金属性逐渐减弱(填“增强”或“减弱”).
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液 3.将一小段镁带投入稀盐酸中 4.将一小片铝投入稀盐酸中 |
| 实验现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)该实验得出的结论是Na、Mg、Al的金属活动性顺序由强到弱.
(4)用原子结构理论解释上述实验结论:同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小(填“增大”或“减小”),原子核对核外电子的引力逐渐增强,失电子能力逐渐减弱(填“增强”或“减弱”),因此金属性逐渐减弱(填“增强”或“减弱”).
14.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
13.依据元素周期表及元素周期律,下列推断正确的是( )
| A. | H2Se(硒化氢)比H2S稳定 | B. | Si、Ge(锗)均可做半导体材料 | ||
| C. | Mg(OH)2的碱性比Be(OH)2的弱 | D. | H3BO3(硼酸)的酸性比H2CO3的强 |
12.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
11.反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的化学反应速率为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
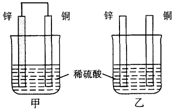
10.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
0 168143 168151 168157 168161 168167 168169 168173 168179 168181 168187 168193 168197 168199 168203 168209 168211 168217 168221 168223 168227 168229 168233 168235 168237 168238 168239 168241 168242 168243 168245 168247 168251 168253 168257 168259 168263 168269 168271 168277 168281 168283 168287 168293 168299 168301 168307 168311 168313 168319 168323 168329 168337 203614

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中硫酸溶液的浓度均下降 | D. | 产生气泡的速度甲比乙慢 |
 .共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.
.共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.