19.下列关于①苯②乙醇③乙酸④葡萄糖等有机物的叙述中,不正确的是( )
| A. | 可以用新制氢氧化铜鉴别③与④ | B. | ①、②、③均能与金属钠反应 | ||
| C. | ①、②、③均能发生取代反应 | D. | 一定条件下,④可以转化为② |
18.下列属于同分异构体的一组是( )
| A. | 35Cl和37Cl | B. | 白磷和红磷 | ||
| C. | H2O和 D2O | D. | 氰酸铵(NH4OCN)与尿素[CO(NH2)2] |
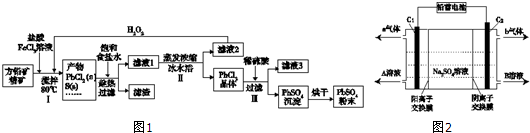
17.硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如图1:
已知:(ⅰ)PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
(1)步骤Ⅰ中生成PbCl2的离子方程式PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓,加入盐酸控制pH值小于2,原因是抑制Fe3+、Pb2+的水解,防止生成Fe(OH)3、Pb(OH)2沉淀.
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出.若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是Fe3+水解生成Fe(OH)3胶体,吸附溶液中悬浮杂质,被共同沉淀.
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)=PbSO4(s)+2Cl-(aq).
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
(6)双隔膜电解池的结构示意简图如图2所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是AD
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑

已知:(ⅰ)PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb( OH)2 | 6 | 7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓,加入盐酸控制pH值小于2,原因是抑制Fe3+、Pb2+的水解,防止生成Fe(OH)3、Pb(OH)2沉淀.
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出.若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是Fe3+水解生成Fe(OH)3胶体,吸附溶液中悬浮杂质,被共同沉淀.
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)=PbSO4(s)+2Cl-(aq).
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
(6)双隔膜电解池的结构示意简图如图2所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是AD
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑
15.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为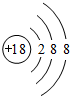 ;最活泼的非金属元素的离子结构示意图
;最活泼的非金属元素的离子结构示意图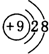 ;最活泼金属元素过氧化物的电子式
;最活泼金属元素过氧化物的电子式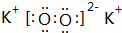 ,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
(2)写出⑤与⑦两元素最高价氧化物对应水化物反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)设计实验方案:比较③与⑧单质氧化性的强弱,请将方案填入下表.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
 ;最活泼的非金属元素的离子结构示意图
;最活泼的非金属元素的离子结构示意图 ;最活泼金属元素过氧化物的电子式
;最活泼金属元素过氧化物的电子式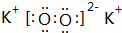 ,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.(2)写出⑤与⑦两元素最高价氧化物对应水化物反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)设计实验方案:比较③与⑧单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |
| 向H2S溶液中通入O2 | 溶液出现浑浊,说明O2的氧化性比S强 |
14.下列关于原子结构、元素性质的说法正确的是( )
| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
13.有关甲、乙两种非金属的下列说法中,能说明甲比乙的非金属性强的是( )
①甲与氢气化合比乙容易
②甲的最高价氧化物对应水化物酸性比乙的强
③甲的单质能与乙的阴离子发生置换反应
④甲的氢化物比乙的稳定
⑤甲的氢化物还原性比乙的强
⑥与金属反应甲得电子比乙多.
①甲与氢气化合比乙容易
②甲的最高价氧化物对应水化物酸性比乙的强
③甲的单质能与乙的阴离子发生置换反应
④甲的氢化物比乙的稳定
⑤甲的氢化物还原性比乙的强
⑥与金属反应甲得电子比乙多.
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
12.下列分子中各原子都满足8e-结构的是( )
| A. | SO2 | B. | CH4 | C. | PCl3 | D. | PCl5 |
11.已知元素R的氢化物的化学式为HnR,其最高价氧化物对应水化物的分子中含有b个氧原子,则其化学式为( )
| A. | H2b+n-8ROb | B. | HnROb | C. | H8-nROb | D. | H2b-n-8ROb |
10.下列有关元素的性质及其递变规律正确的是( )
0 168135 168143 168149 168153 168159 168161 168165 168171 168173 168179 168185 168189 168191 168195 168201 168203 168209 168213 168215 168219 168221 168225 168227 168229 168230 168231 168233 168234 168235 168237 168239 168243 168245 168249 168251 168255 168261 168263 168269 168273 168275 168279 168285 168291 168293 168299 168303 168305 168311 168315 168321 168329 203614
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | ⅠA和ⅦA族元素间可形成离子化合物和共价化合物 | |
| C. | 同主族元素的简单阴离子还原性越强,元素非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其金属性越强 |