题目内容
14.下列关于原子结构、元素性质的说法正确的是( )| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
分析 A、同一周期元素,元素的金属性随着原子序数的增大而减弱;
B、同一元素的原子中质子数相等、核外电子数相等;
C、非金属元素组成的化合物中可能含有离子键,一定含有共价键;
D、ⅦA族元素的阴离子还原性越强,元素的非金属越弱.
解答 解:A、同一周期元素,元素的金属性随着原子序数的增大而减弱,所以ⅠA族金属元素是同周期中金属性最强的元素,故A正确;
B、同一元素的原子中质子数相等、核外电子数相等,但中子数不同,故B错误;
C、非金属元素组成的化合物中可能含有离子键,一定含有共价键,而不只含共价键,故C错误;
D、ⅦA族元素的阴离子还原性越强,元素的非金属越弱,所以其最高价氧化物对应水化物的酸性越弱,故D错误;
故选:A.
点评 本题考查了原子结构和元素性质,结构决定性质,再结合元素周期律分析解答,注意规律中的例外情况,为易错点.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.核磁共振氢谱(1HNMR)是研究有机物分子结构的方法之一,每个有机物分子结构中的氢原子在1HNMR上都给出了相应的红外吸收峰(信号),每种峰的强度与结构中的氢原个子数成正比.则乙醇(CH3CH2OH)分了在1HNMR中的信号和强度分别是( )
| A. | 两个信号,强度之比为1:1 | B. | 三个信号,强度之比为3:2:1 | ||
| C. | 两个信号,强度之比为3:1 | D. | 三个信号,强度之比为1:1:1 |
5.针对如图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是( )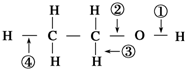

| A. | 在Ag催化下与O2反应时,①、③键断裂 | B. | 分子间脱水时,①②键断裂 | ||
| C. | 与浓硫酸共热至170℃时,②、④键断裂 | D. | 与醋酸、浓硫酸共热时,②键断裂 |
2.下列说法正确的是( )
| A. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | Li是最活泼金属,F是最活泼非金属 |
9.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 四种元素位于同一周期 | B. | b+1=d-1 | ||
| C. | 氢化物稳定性:H2Y>HZ | D. | 离子的氧化性:W3+>X+ |
19.下列关于①苯②乙醇③乙酸④葡萄糖等有机物的叙述中,不正确的是( )
| A. | 可以用新制氢氧化铜鉴别③与④ | B. | ①、②、③均能与金属钠反应 | ||
| C. | ①、②、③均能发生取代反应 | D. | 一定条件下,④可以转化为② |
6.具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )
| A. | 两种元素原子的电子层上全部都是s电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子 | |
| D. | M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子 |
3.下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 检验工业废水中是否含有苯酚 | 在试管中加入2 mL工业废水样品,然后加入2滴浓溴水,振荡,观察是否产生白色沉淀 |
| B | 验证乙醛中含有醛基 | 在试管中加入2 mL10%的CuSO4溶液,然后加入4至6滴2%的NaOH溶液振荡,再加入0.5 mL乙醛溶液加热煮沸,观察是否出现红色沉淀 |
| C | 提纯粗苯甲酸 | 将1g粗苯甲酸溶于50mL蒸馏水,加热使之全部溶解,趁热过滤,将滤液冷却结晶,滤出晶体 |
| D | 证明溴乙烷发生消去反应生成乙烯 | 将产生的气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
4.下列关于原子的几种描述中,正确的是( )
| A. | 硫的原子结构示意图: | |
| B. | Be2+离子中的质子数和电子数之比为2:1 | |
| C. | 原子核内有8个中子的碳原子:${\;}_{8}^{14}$C | |
| D. | 同一元素的各种同位素的物理性质、化学性质均相同 |