14.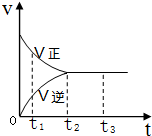 在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
 在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )| A. | t1时,只有正反应在进行 | |
| B. | t2~t3时间段,反应停止 | |
| C. | t2时,容器内有1.5mol Y | |
| D. | t2~t3时间段,X,Y的物质的量均没有发生变化 |
12.下列图示与对应的叙述一定正确的是( )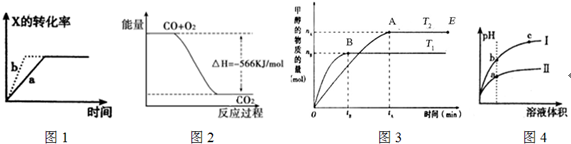

| A. | 图1所示,反应X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2═CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a |
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| B. | 0.1molNa2O2晶体中含有0.3NA个离子 | |
| C. | pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
10.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
x=25时,假设2成立.
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
9.下列说法错误的是( )
| A. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0 | |
| C. | 将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱 | |
| D. | 用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程 |
7.原子序数依次递增的4种短周期元素可形成简单离子 W2-,X+,Y3+,Z2-,下列说法不正确的是( )
0 167995 168003 168009 168013 168019 168021 168025 168031 168033 168039 168045 168049 168051 168055 168061 168063 168069 168073 168075 168079 168081 168085 168087 168089 168090 168091 168093 168094 168095 168097 168099 168103 168105 168109 168111 168115 168121 168123 168129 168133 168135 168139 168145 168151 168153 168159 168163 168165 168171 168175 168181 168189 203614
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:W2->X+>Y3+>Z2-? | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
 某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:
某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下: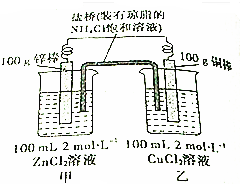

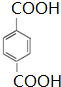 .
. +2Br2$\stackrel{光照}{→}$
+2Br2$\stackrel{光照}{→}$ +2HBr.?
+2HBr.? $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$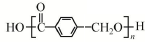 +(n-1)H2O.
+(n-1)H2O.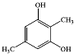 .
.