题目内容
14.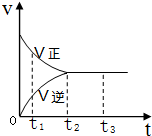 在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )| A. | t1时,只有正反应在进行 | |
| B. | t2~t3时间段,反应停止 | |
| C. | t2时,容器内有1.5mol Y | |
| D. | t2~t3时间段,X,Y的物质的量均没有发生变化 |
分析 A、t1时,图中正反应速率大于逆反应速率;
B、根据图可知,t2~t3时间段,正逆反应速率相等,反应处于平衡状态;
C、可逆反应不能完全正向进行或完全逆向进行;
D、t2~t3时间段,正逆反应速率相等,反应达平衡状态,据此判断.
解答 解:A、t1时,图中正反应速率大于逆反应速率,逆反应速率不等于0,所以既有正方向反应,又有逆反应,故A错误;
B、根据图可知,t2~t3时间段,正逆反应速率相等,反应处于平衡状态,平衡状态是一种动态平衡状态,所以反应没有停止,故B错误;
C、1mol X完全正向进行可生成1.5mol Y,但可逆反应不能完全正向进行或完全逆向进行,所以t2时,容器内有Y的物质的量不可能达到1.5mol,故C错误;
D、t2~t3时间段,正逆反应速率相等,反应达平衡状态,所以X,Y的物质的量均没有发生变化,故D正确;
故选D.
点评 本题考查了可逆反应的定义及化学平衡状态的判断,难度中等,注意化学平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | C3H8的二氯代物共有3种 |
2.利用图1所示实验(部分装置)收集氯气并验证氯气的性质:
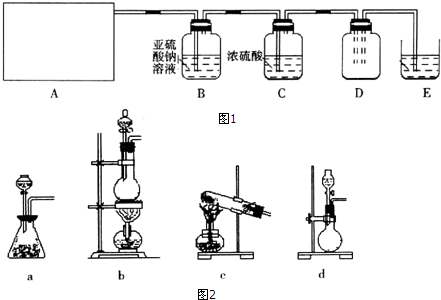
(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.

(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
9.下列说法错误的是( )
| A. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0 | |
| C. | 将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱 | |
| D. | 用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程 |
19.某单烯烃与氢气加成以后的产物是(CH3)2CHCH(CH3)C(CH3)3,该烯烃可能结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
6.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
该氢化物的化学式为MgH2.
(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
4.石油、煤加工是各种脂肪烃的重要来源,下列判断正确的是( )
| A. | 石油常压蒸馏得到的汽油属于纯净物 | |
| B. | 石油减压蒸馏、煤的液化和气化都是化学变化 | |
| C. | 石油催化裂化的目的是获得更多甲烷 | |
| D. | 石油催化裂化的产物能使溴水和酸性KMnO4溶液褪色 |
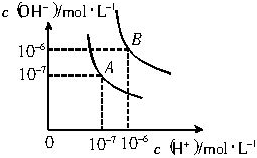 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.