3.运用元素周期律分析下列推断,其中错误的是( )
| A. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 硫酸锶难溶于水 |
2.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧产生苍白色火焰,产物溶于水得到一种强酸.回答下列问题:
(1)F在周期表中的位置是第三周期ⅦA族,写出一种工业制备单质F的化学方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,所含化学键类型有离子键和共价键.
(3)由上述五种元素中的某些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的电子式为 ;c的结构式为H-O-Cl.
;c的结构式为H-O-Cl.
(1)F在周期表中的位置是第三周期ⅦA族,写出一种工业制备单质F的化学方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,所含化学键类型有离子键和共价键.
(3)由上述五种元素中的某些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为AFD |
 ;c的结构式为H-O-Cl.
;c的结构式为H-O-Cl.
1.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.下列说法正确的是( )


| A. | c为正极、d为负极 | |
| B. | 电路中电子的流动方向:b-d-CuCl2溶液-c-a | |
| C. | 电解过程中,d电极质量增加 | |
| D. | 电解过程中,氯离子浓度不变 |
20.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应中,反应物吸收环境中的热量转化为产物内部的能量 |
19.化学与社会、生活和生产息息相关,以下叙述错误的是( )
| A. | 科学家们正在研究利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气 | |
| B. | 贮氢金属在一定温度和压强下可以吸附氢气,如镧镍合金(LaNi5)可以吸附氢气形成LaNi5H6,其中H元素仍以H2分子形式存在 | |
| C. | 氢气因具有高热值、燃烧产物无污染等优点而被看成是理想的绿色能源 | |
| D. | 燃烧树枝取热、将植物秸杆制沼气、用淀粉制乙醇都是人们利用生物质能的方式 |
15.下列叙述错误的是( )
| A. | 工业上,乙苯主要通过苯与乙烯在合适条件下加成反应获得 | |
| B. | 实验室制得的溴苯含有多种有机杂质,除了苯之外,还可能含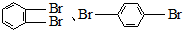 | |
| C. | 萘(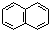 )不是苯的同系物,应属于联苯类芳香烃 )不是苯的同系物,应属于联苯类芳香烃 | |
| D. | D.甲苯与氯气在光照下反应生成的一氯代物主要为 |
14.有机物: 有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )
有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )
0 167965 167973 167979 167983 167989 167991 167995 168001 168003 168009 168015 168019 168021 168025 168031 168033 168039 168043 168045 168049 168051 168055 168057 168059 168060 168061 168063 168064 168065 168067 168069 168073 168075 168079 168081 168085 168091 168093 168099 168103 168105 168109 168115 168121 168123 168129 168133 168135 168141 168145 168151 168159 203614
 有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )
有多种同分异构体,其中属于酯类并含有苯环的同分异构体有(不考虑立体异构( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |


 .
. .
.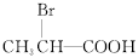 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$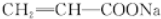 +NaBr+2H2O
+NaBr+2H2O .
.  CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应.
CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应. .
. +4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+
+4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+ +2H2O.
+2H2O.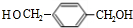 .
.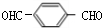 +2H2O.
+2H2O.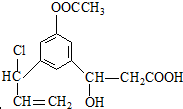 发生反应为①②③④⑤⑥
发生反应为①②③④⑤⑥