题目内容
2.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧产生苍白色火焰,产物溶于水得到一种强酸.回答下列问题:(1)F在周期表中的位置是第三周期ⅦA族,写出一种工业制备单质F的化学方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱,所含化学键类型有离子键和共价键.
(3)由上述五种元素中的某些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为AFD |
 ;c的结构式为H-O-Cl.
;c的结构式为H-O-Cl.
分析 A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,则E处于IA族,D处于ⅥA族,则E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl.
(1)工业上常用电解饱和食盐水或电解熔融氯化钠来制备氯气;
(2)C、O、Na组成的一种盐,Na的质量分数为43%,则该盐为碳酸钠;
(3)a由两种元素组成含有氢元素的离子化合物,这几种元素只有Na能与H形成离子化合物,故a为NaH;b由两种元素组成含有非极性共价键的离子化合物,且原子数之比为1:1,则b为Na2O2;c的化学组成为HClO.
解答 解:A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,则E处于IA族,D处于ⅥA族,则E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl.
(1)F为Cl元素,处于周期表中第三周期ⅦA族;工业上常用电解饱和食盐水或电解熔融氯化钠来制备氯气,电解饱和氯化钠溶液离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:第三周期ⅦA族;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)C、O、Na组成的一种盐,Na的质量分数为43%,则该盐为碳酸钠,俗名为纯碱,为离子化合物,含有离子键和共价键,
故答案为:纯碱;离子键和共价键;
(3)a由两种元素组成含有氢元素的离子化合物,这几种元素只有Na能与H形成离子化合物,故a为NaH;b由两种元素组成含有非极性共价键的离子化合物,且原子数之比为1:1,则b为Na2O2,电子式为,c的化学组成为HClO,其结构式为H-O-Cl,
故答案为:NaH; ;H-O-Cl.
;H-O-Cl.
点评 本题考查元素化合物推断,为高考常见题型和高频考点,侧重学生的分析能力的考查,题目涉及的知识点较多,侧重于考查学生对所学知识点综合应用能力,题目难度中等.

| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 | |
| C. | iPhone6外壳易掉色是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| D. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
| A. | 通入氧气的一极是负极 | |
| B. | 放电时,溶液中的OH-向正极移动 | |
| C. | 反应中若有6mol电子发生转移,则有32g CH3OH被还原 | |
| D. | 该电池工作时甲醇一极附近溶液的pH降低 |
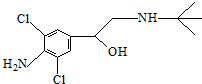
| A. | 该物质在一定条件下可发生消去反应和酯化反应 | |
| B. | 该物质分子中含有6个饱和碳原子 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多需NaOH 2 mol | |
| D. | 该物质的分子式为C12H18ON2Cl2 |
已知部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
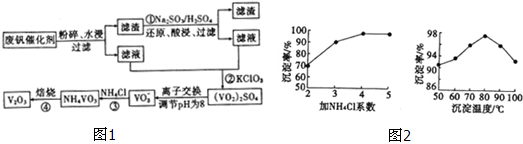
(1)工业由V2O5冶炼金厲钒常用铝热法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤液中含钒的主要成分为VOSO4 (写化学式).
(3)反应③的沉淀率是回收钒的关键,该步反应的离子方程式为NH4++VO3-=NH4VO3↓;沉淀率的髙
低除受溶液pH影响外,还与氯化按系数(NH4Cl加入质量与样品中V2O5的质量比)和温度有关.根据图2判断最佳氯化铵系数和温度分别为4、80°C.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,该滴定反应的离子方程式2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O.若产生2.24L的CO2(标准状况下),则转移电子数为0.1NA.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO${\;}_{2}^{+}$+V2++H+ $?_{放电}^{充电}$ VO2++H2O+V3+
电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在这些元素中,在最高价氧化物的水化物中,酸性最强的元素是Cl,碱性最强的元素是K.
(3)表中元素⑥的原子结构示意图是
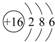 ;④的离子结构示意图
;④的离子结构示意图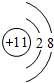 .
.(4)最高价氧化物的水化物显两性的化合物是Al(OH)3;写出它与④的氢氧化物水溶液反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(5)用电子式表示:元素④与⑥形成的化合物:
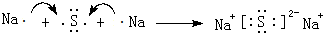 .
. | A. | C3H6、C2H4 | B. | C2H6、C2H6O | C. | C2H4、C2H6O | D. | C3H4、C2H6O |
 CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应.
CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应. .
. +4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+
+4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+ +2H2O.
+2H2O.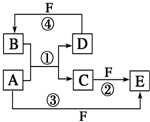 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).