3.某有机物结构如图所示,则下列关于该有机物的说法中不正确的是( )
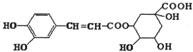
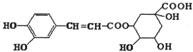
| A. | 该有机物在一定条件下可以发生消去反应 | |
| B. | 1mol该有机物与足量的溴水反应时最多消耗4molBr2 | |
| C. | 该有机物不能使酸性高锰酸钾溶液褪色 | |
| D. | 该有机物在一定条件下可以发生水解反应和酯化反应 |
2.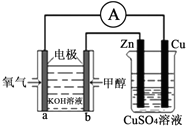 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )| A. | 该装置中Cu极为阳极 | |
| B. | 该装置中右池为电镀池,电解过程中CuSO4溶液pH不变 | |
| C. | b极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为1.12L |
1.下列说法正确的是( )
| A. | 将SO2分别通入BaCl2、Ba(NO3)2溶液中,都会观察到有白色沉淀生成 | |
| B. | 检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 纯锌与稀硫酸反应产生氢气的速率较慢,加入少量硫酸铜固体后,反应速率会加快 | |
| D. | 对于任意化学平衡,只要增大反应物浓度,都会使反应物转化率增大 |
20.下列各组离子,在所给条件下一定能够大量共存的是( )
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、NO3-、SO42- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Ca2+、Mg2+、ClO-、I- | |
| C. | 在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br- | |
| D. | 加入苯酚显紫色的溶液中:Na+、Mg2+、Cl-、SO42- |
19.下列离子方程式正确的是( )
| A. | 向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O | |
| B. | H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2 | |
| C. | 0.1mol/L CuCl2溶液中加入0.1mol/L NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑ | |
| D. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- |
18. 瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )
瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )
 瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )
瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )| A. | 石墨烯和石墨燃烧都生成二氧化碳,说明它们互为同分异构体 | |
| B. | 石墨烯一定条件下可与氢气发生反应生成石墨烷 | |
| C. | 石墨烯在室温下传递电子的速度快是因为碳原子间以极性键结合 | |
| D. | 12g石墨烯中含有NA个六元碳环 |
17.2010年11月12日至27日广州成功举办了第16届亚运会.广州采取了一系列节能减排、改善环境质量的措施.下列说法错误的是( )
| A. | 发展核能发电,以减少火力发电带来的SO2和CO2的排放问题 | |
| B. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| C. | 推行“限塑令”,研发用二氧化碳合成聚碳酸酯类可降解塑料 | |
| D. | 使用填埋法或焚烧法处理未经分类的生活垃圾 |
15.在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Νι(ΧΟ)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2.下列说法正确的是( )
0 167961 167969 167975 167979 167985 167987 167991 167997 167999 168005 168011 168015 168017 168021 168027 168029 168035 168039 168041 168045 168047 168051 168053 168055 168056 168057 168059 168060 168061 168063 168065 168069 168071 168075 168077 168081 168087 168089 168095 168099 168101 168105 168111 168117 168119 168125 168129 168131 168137 168141 168147 168155 203614
| A. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4百分含量将增大 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 上述生成Ni(CO)4(g)的反应为吸热反应 |
 氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分.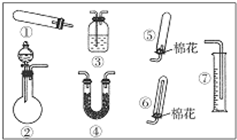 某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题:
某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题: