题目内容
20.下列各组离子,在所给条件下一定能够大量共存的是( )| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、NO3-、SO42- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Ca2+、Mg2+、ClO-、I- | |
| C. | 在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br- | |
| D. | 加入苯酚显紫色的溶液中:Na+、Mg2+、Cl-、SO42- |
分析 A.该溶液为中性溶液,铁离子、镁离子部分水解,溶液显示酸性;
B.该溶液中存在大量氢氧根离子,次氯酸根离子能够氧化碘离子,钙离子、镁离子能够与氢氧根离子反应;
C.碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀;
D.加入苯酚显紫色的中含有铁离子,四种离子之间不反应,都不与铁离子反应.
解答 解:A.常温下pH=7的溶液为中性溶液,而Fe3+、Mg2+在溶液中部分水解,溶液显示酸性,不可能为中性,故A错误;
B.常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液为碱性溶液,溶液中存在大量氢氧根离子,Ca2+、Mg2+与氢氧根离子反应,ClO-、I-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.HCO3-、AlO2-之间发生反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故C错误;
D.加入苯酚显紫色的溶液中存在Fe3+,Na+、Mg2+、Cl-、SO42-之间不发生反应,都不与铁离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
10.下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )
| A. | 10℃20 mL 3mol/L的X溶液 | B. | 20℃30 mL 2molL的X溶液 | ||
| C. | 20℃10 mL 4mol/L的X溶液 | D. | 10℃10 mL 2mol/L的X溶液 |
11.钴(Cu)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与Na2CO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+6H++5Cl-=3Cl2↑+3H2O,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.[M (CoC2O4•2H2O)=183 g/mol]
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,证明晶体已经洗涤干净的操作及现象是取最后一次洗涤液于试管中,加入几滴稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,说明已经洗净.

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al2+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与Na2CO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+6H++5Cl-=3Cl2↑+3H2O,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,证明晶体已经洗涤干净的操作及现象是取最后一次洗涤液于试管中,加入几滴稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,说明已经洗净.
15.在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Νι(ΧΟ)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2.下列说法正确的是( )
| A. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4百分含量将增大 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 上述生成Ni(CO)4(g)的反应为吸热反应 |
9.由1,3-丁二烯合成2-氯-1,3-丁二烯的路线如下:该路线中各步的反应类型分别为( )


| A. | 加成、水解、加成、消去 | B. | 取代、水解、取代、消去 | ||
| C. | 加成、取代、取代、消去 | D. | 取代、取代、加成、氧化 |
10.下列实验能成功的是( )
| A. | 将乙酸和乙醇混合加热制乙酸乙酯 | |
| B. | 乙醇、浓硫酸加热到140℃制乙烯 | |
| C. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |

 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O.
+H2O. +2Na2CO3→
+2Na2CO3→ +2NaHCO3.
+2NaHCO3. .
. +2Br2→
+2Br2→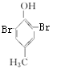 +2HBr
+2HBr
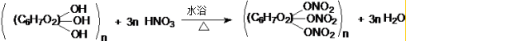 .
.