3.下面有关氨气的实验原理的分析中,不正确的是( )
| A. | 氨气的还原性可以解释氨气与氯化氢的反应实验 | |
| B. | NH3•H2O的热不稳定性可以解释实验室中可采用加热氨水的方法制取氨气 | |
| C. | 检验铵盐的方法是将待检物取出少量放在试管中,加苛性钠溶液,加热,用湿润红色石蕊试纸在试管口检验是否产生氨气 | |
| D. | 氨气极易溶解于水的性质可以解释氨气的喷泉实验 |
2.对下列事实的解释正确的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 | |
| B. | 向某溶液中加入氯化钡溶液和稀硝酸,生成白色沉淀,则原溶液一定含有SO42- | |
| C. | 常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 | |
| D. | 浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸 |
1.下列A、B两种元素的原子序数,其中可以组成AB2型共价化合物的是( )
| A. | 19和16 | B. | 6和8 | C. | 12和8 | D. | 10和2 |
20.下列说法中,正确的是( )
| A. | 非金属元素之间形成的化合物一定是共价化合物 | |
| B. | 在气态单质分子中不一定存在着共价键 | |
| C. | 两个原子或多个原子之间的相互作用叫化学键 | |
| D. | 离子化合物中一定含有离子键,不存在共价键 |
19.某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:

根据以上信息,下列观点正确的是( )

根据以上信息,下列观点正确的是( )
| A. | 沉淀G的化学式为Fe(OH)2 | |
| B. | 生成气体A的离子方程式为2Fe2++NO3-+4H+=2Fe3++NO↑+2H2O | |
| C. | 反应②中的离子方程式有AlO2-+CO2+2H2O=Al(OH)3+HCO3- | |
| D. | 溶液X中,除H+ 外还肯定含有的离子是NH4+、Fe2+、SO42-. |
17.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.你的解释是Mn2+的3d轨道电子排布为半满状态较稳定.
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子间存在氢键,与水分子可形成氢键.
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
| 元 素 | M | F | |
| 电能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
16. 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )| A. | 电解时惰性电极应与直流电源的负极相连 | |
| B. | 通电后阴极室产生的现象为:产生无色气体,溶液由无色变黄色 | |
| C. | 制备过程中总的离子方程式为:2CrO42-+3H2O=Cr2O72-+2OH-+2H2↑+O2↑ | |
| D. | 若实验开始时在右室中加入38.8克的K2CrO4,tmin后测得右室中K与Cr的物质的量之比为3:2,此时电路中转移电子的物质的量为0.1mol |
15.下列有关有机物的说法正确的是( )
| A. | (CH3CH2)2CHCH3的系统命名是2-乙基丁烷 | |
| B. | 葡萄糖在不同的条件下可以发生取代、加成、消去、氧化、还原、酯化反应 | |
| C. | 有机同系物具有相同的通式,且组成相差n个CH2,因此等质量的同系物完全燃烧耗氧相差物质的量为1.5nmol | |
| D. | 分离乙酸乙酯、乙酸、乙醇的混和物流程如下: |
14.A、B、C、D、E为五种短周期元素.A、B、C是原子序数依次递增的同周期元素,且最外层电子数之和为15,A与C可形成AC2分子;B与D形成的气态化合物在标况下的密度为0.76g/L;E的质子数是A、B、C、D四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
0 167959 167967 167973 167977 167983 167985 167989 167995 167997 168003 168009 168013 168015 168019 168025 168027 168033 168037 168039 168043 168045 168049 168051 168053 168054 168055 168057 168058 168059 168061 168063 168067 168069 168073 168075 168079 168085 168087 168093 168097 168099 168103 168109 168115 168117 168123 168127 168129 168135 168139 168145 168153 203614
| A. | B的最简气态氢化物的热稳定性比A的强是因为其最简气态氢化物分子间存在氢键 | |
| B. | 由A元素构成的单质均具有熔点高、硬度大的特性 | |
| C. | 常温下E与D元素形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由A、B、C、D四种元素形成的化合物一定既有离子键,又有共价键 |
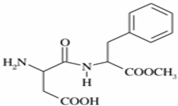 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.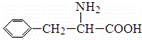 是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: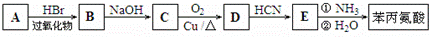
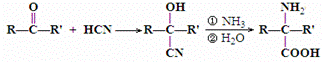
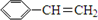

 .
.