题目内容
15.下列有关有机物的说法正确的是( )| A. | (CH3CH2)2CHCH3的系统命名是2-乙基丁烷 | |
| B. | 葡萄糖在不同的条件下可以发生取代、加成、消去、氧化、还原、酯化反应 | |
| C. | 有机同系物具有相同的通式,且组成相差n个CH2,因此等质量的同系物完全燃烧耗氧相差物质的量为1.5nmol | |
| D. | 分离乙酸乙酯、乙酸、乙醇的混和物流程如下: |
分析 A.(CH3CH2)2CHCH3最长碳链有5个碳原子;
B.已经葡萄糖含有醛基、醇羟基官能团的结构解答;
C.甲烷与乙烷为同系物,依据等质量甲烷与乙烷耗氧量判断;
D.盐酸易挥发蒸馏乙酸时容易引人杂质,据此解答.
解答 解:A.(CH3CH2)2CHCH3最长碳链有5个碳原子,系统命名为:3-甲基戊烷,故A错误;
B.葡萄糖含有醛基能够发生氧化反应生成酸,能够发生还原反应生成醇,含有醇羟基能够发生消去反应,能够发生酯化反应,故B正确;
C.甲烷与乙烷为同系物,取mg二者,分别燃烧,甲烷耗氧量为$\frac{1}{8}$mol,乙烷耗氧量为$\frac{3.5mol}{30}$,二者不相等,故C错误;
D.乙酸乙酯在饱和碳酸钠中的溶解度比较小,混合物加入饱和碳酸钠碳溶液后分液得到不溶于性乙酸乙酯A,和水层B,B中溶解乙醇,乙醇与碳酸钠、醋酸钠溶液沸点不同,通过蒸馏可以分离出乙醇,向剩余水层中加入盐酸,盐酸的酸性强于碳酸、醋酸,但是盐酸为挥发性酸,蒸馏分离乙酸时能引入杂质,故D错误;
故选:B.
点评 本题为综合题,考查了有烷烃的系统命名、葡萄糖的性质、同系物性质、物质的分离与提纯,题目难度中等,熟悉葡萄糖中含有官能团、熟悉同系物结构特点是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5. 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
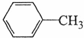 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$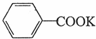 +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O
 +HCl→
+HCl→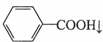 +KCl
+KCl
实验步骤:
①按图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)三颈烧瓶所盛液体体积通常占其容积的1/3~2/3,则本实验应选择的三颈烧瓶规格为B(填字母序号).A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯己完全反应的现象是三颈烧瓶内溶液不分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成的损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)写出碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀的离子方程式2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL.V2=24.80mL.V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是加入最后一滴NaOH溶液,溶液由无色变为浅红色.
③产品的纯度为99.00%.
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→ +KCl
+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 不溶 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃,2.7g | 易溶 |
①按图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)三颈烧瓶所盛液体体积通常占其容积的1/3~2/3,则本实验应选择的三颈烧瓶规格为B(填字母序号).A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯己完全反应的现象是三颈烧瓶内溶液不分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成的损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)写出碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀的离子方程式2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL.V2=24.80mL.V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是加入最后一滴NaOH溶液,溶液由无色变为浅红色.
③产品的纯度为99.00%.
6.设NA为阿佛加德罗常数,下列说法不正确的是( )
| A. | 标准状况下的22.4 L辛烷完全燃烧,生成二氧化碳分子数为8 NA | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3 NA | |
| C. | 常温常压下,22.4 L甲烷中含C-H键的数目为4NA | |
| D. | 常温常压下,3g甲醛分子中含电子数1.6 NA |
3.禁止用工业酒精配制饮料酒,这是因为工业酒精中常含有会使人中毒的( )
| A. | 乙醚 | B. | 乙二醇 | C. | 丙三醇 | D. | 甲醇 |
20.下列说法中,正确的是( )
| A. | 非金属元素之间形成的化合物一定是共价化合物 | |
| B. | 在气态单质分子中不一定存在着共价键 | |
| C. | 两个原子或多个原子之间的相互作用叫化学键 | |
| D. | 离子化合物中一定含有离子键,不存在共价键 |
7.电解CuSO4溶液时,要求达到三点:(1)阳极质量减少;(2)阴极质量增加;(3)电解质溶液中c(Cu2+)不变,则可选用的电极是( )
| A. | 纯铜作阳极,含Zn和Ag的铜合金作阴极 | |
| B. | 含Zn和Ag的铜合金作阳极,纯铜作阴极 | |
| C. | 用纯铁作阳极,纯铜作阴极 | |
| D. | 用石墨作阴极,纯铜作阳极 |
4.取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份,一份中通入足量的H2并加热,反应后固体质量减少6.4g.另一份中加入500mL的稀硝酸溶液,固体恰好完全溶解,生成NO4.48L(标准状况),则转化过程中所加稀硝酸的物质的量浓度为( )
| A. | 2.8mol/L | B. | 3.0mol/L | C. | 3.2mol/L | D. | 3.6mol/L |
5.已知:P4(g)+6Cl2(g)=4PCl3(g).1mol P4(g)与氯气完全反应生成PCl3(g)放出a kJ的热量,P4具有正四面体结构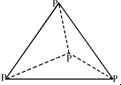 ,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )
,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )
 ,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )
,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )| A. | 1 mol P4(g)和1 mol Cl2(g)所具有的能量和大于1 mol PCl3(g) 所具有的能量 | |
| B. | 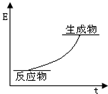 该反应的能量图象可表示 该反应的能量图象可表示 | |
| C. | 形成1mol P-P键放出-($\frac{a}{6}$-2b+c) kJ的热量 | |
| D. | 因为该反应为放热反应,故不需要任何条件就能快速进行 |
 ;
;