2.下列变化中,元素价态变化与反应:3NO2+H2O═2HNO3+NO属于同一类型的是( )
| A. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ | |
| B. | 2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O | |
| C. | 3Br2+6NaOH═NaBrO3+5NaBr+3H2O | |
| D. | 5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
6.25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
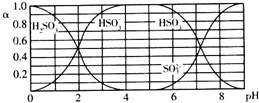

| A. | 溶液的pH=5时,硫元素的主要存在形式为HSO3- | |
| B. | 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,$\frac{{c({HSO_3^-})}}{{c({SO_3^{2-}})}}$的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
4.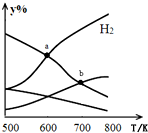 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | |
| B. | b点,v正(CO2)=v逆(H2O) | |
| C. | a点,H2和H2O物质的量相等 | |
| D. | 其他条件恒定,充入更多H2,v(CO2)不变 |
2.某化学反应:A(g)?B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是( )


| A. | 0~50秒,A物质化学反应速率v(A)=0.0016mo 1•L-1•S-1 | |
| B. | 250s时该反应达到化学平衡状态 | |
| C. | 若改加入2.0mol A,A的平衡转化率大于20% | |
| D. | 300K时,该反应的平衡常数为0.025 mol•L-1 |
1.酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示.下列表述不正确的是( )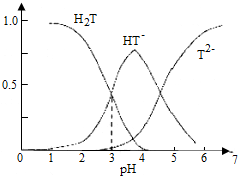
0 167949 167957 167963 167967 167973 167975 167979 167985 167987 167993 167999 168003 168005 168009 168015 168017 168023 168027 168029 168033 168035 168039 168041 168043 168044 168045 168047 168048 168049 168051 168053 168057 168059 168063 168065 168069 168075 168077 168083 168087 168089 168093 168099 168105 168107 168113 168117 168119 168125 168129 168135 168143 203614

| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
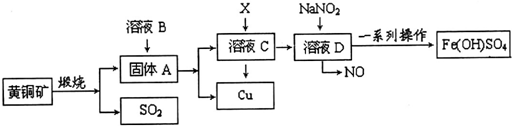
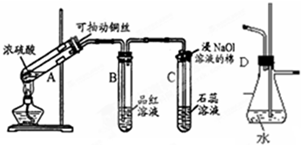 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题:
 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).