题目内容
20.工业上煅烧黄铜矿(CuFeS2)冶炼铜并得到碱式硫酸铁[Fe(OH)SO4]等其他重要化合物,主要流程如下(部分反应物和产物未标出):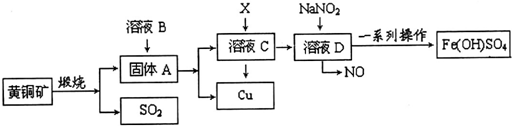
已知4CuFeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$4Cu+2Fe2O3+8SO2
(1)溶液B是H2SO4;X是Fe.
(2)某同学取溶液C滴入KSCN溶液,溶液不变红,说明溶液C中不含Fe3+,其原因是氧化铁溶解后的铁盐溶液具有氧化性,能氧化铜,生成的铁离子全部被铜还原为亚铁离子,Fe2O3+6H+=2Fe3++3H2O,2Fe3++Cu=2Fe2++Cu2+,(用简单的文字和离子方程式说明):再向该溶液中滴入H2O2溶液,溶液变红色.则滴入H2O2溶液发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在溶液D与NaNO2的反应中,常采用同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂,如参加反应的O2有11.2L(标况),则相当于节约NaNO2物质的量为2mol.
(4)该法得到的金属铜中常含有金、银、铁、镍等金属杂质,常用电解精炼的方法得到纯铜,请在右边框内画出其原理装置示意图.

(5)[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,它溶于水后产生的Fe(OH)2+ 离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.
分析 已知4CuFeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$4Cu+2Fe2O3+8SO2 ,固体A为Cu和2Fe2O3,加入硫酸溶解后过滤分离出Cu,滤液C为硫酸铁溶液和铁离子溶解的部分铜写出的铜盐,加入X为铁粉,用来还原铁离子和铜离子,得到溶液D为氯化亚铁溶液,加入亚硝酸钠氧化亚铁离子为铁离子,经过一系列操作制备得到碱式硫酸铁[Fe(OH)SO4];
(1)上述分析可知B为硫酸,X为铁;
(2)某同学取溶液C滴入KSCN溶液,溶液不变红,说明溶液C中不含Fe3+,原因是氧化铁溶解后的铁盐溶液具有氧化性,能氧化铜,则生成的铁离子全部被铜还原为亚铁离子,再向该溶液中滴入H2O2溶液,溶液变红色,是利用过氧化氢氧化亚铁离子为铁离子,铁离子结合硫氰酸根离子写出血红色溶液;
(3)在溶液D与NaNO2的反应中,常采用同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中做氧化剂氧化亚铁离子,结合氧气做氧化剂和亚硝酸钠做氧化剂时电子守恒计算相当于NaNO2物质的量,所消耗氧气得到的电子的物质的量相当于NaNO2得到电子的物质的量;
(4)电解精炼的方法得到纯铜,粗铜做电解池的阳极,精铜做阴极,含铜离子的电解质做电解质溶液,据此画出装置图;
(5)根据反应物和生成物判断离子方程式.
解答 解:已知4CuFeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$4Cu+2Fe2O3+8SO2 ,固体A为Cu和2Fe2O3,加入硫酸溶解后过滤分离出Cu,滤液C为硫酸铁溶液和铁离子溶解的部分铜写出的铜盐,加入X为铁粉,用来还原铁离子和铜离子,得到溶液D为氯化亚铁溶液,加入亚硝酸钠氧化亚铁离子为铁离子,经过一系列操作制备得到碱式硫酸铁[Fe(OH)SO4];
(1)上述分析可知B为硫酸,X为铁,化学式为H2SO4、Fe,
故答案为:H2SO4;Fe;
(2)某同学取溶液C滴入KSCN溶液,溶液不变红,说明溶液C中不含Fe3+,原因是氧化铁溶解后的铁盐溶液具有氧化性,能氧化铜,生成的铁离子全部被铜还原为亚铁离子,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,2Fe3++Cu=2Fe2++Cu2+,再向该溶液中滴入H2O2溶液,溶液变红色,是利用过氧化氢氧化亚铁离子为铁离子,铁离子结合硫氰酸根离子写出血红色溶液,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:氧化铁溶解后的铁盐溶液具有氧化性,能氧化铜,生成的铁离子全部被铜还原为亚铁离子,Fe2O3+6H+=2Fe3++3H2O,2Fe3++Cu=2Fe2++Cu2+;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)在溶液D与NaNO2的反应中,常采用同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中做氧化剂,n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2molNaNO2,
故答案为:氧化剂;2;
(4)电解精炼的方法得到纯铜,粗铜做电解池的阳极,精铜做阴极,含铜离子的电解质做电解质溶液,据此画出装置图为 ,
,
故答案为: ;
;
(5)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+,
故答案为:2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.
点评 本题考查了物质分离提纯的实验工程分析,主要是离子性质的分析判断,氧化还原反应离子方程式的书写和定量计算,电解池原理的应用,掌握基础是关键,题目难度中等.

 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol•L-1 |
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | x mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.

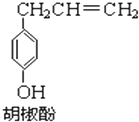 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法: