题目内容
2.下列变化中,元素价态变化与反应:3NO2+H2O═2HNO3+NO属于同一类型的是( )| A. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ | |
| B. | 2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O | |
| C. | 3Br2+6NaOH═NaBrO3+5NaBr+3H2O | |
| D. | 5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
分析 在3NO2+H2O═2HNO3+NO的反应中,反应物NO2中N元素的化合价由+4价分别升高为+5价和降低到+2价,则在反应中既是氧化剂又是还原剂,据此解答即可.
解答 解:在3NO2+H2O═2HNO3+NO的反应中,反应物NO2中N元素的化合价由+4价分别升高为+5价和降低到+2价,则在反应中既是氧化剂又是还原剂,
A、2FeCl3+H2S═2FeCl2+2HCl+S↓,此反应中Fe元素又+3价被还原+2价,S元素由-2价升高到0价,被氧化,与3NO2+H2O═2HNO3+NO不同,故A错误;
B、2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O,此反应Cr元素由+6价被还原为+3价,N元素由-3价升高到0价,被氧化,与3NO2+H2O═2HNO3+NO不同,故B错误;
C、3Br2+6NaOH═NaBrO3+5NaBr+3H2O,此反应中Br既是氧化剂又是氧化剂,部分升高到+5价,部分降低到-1价,与3NO2+H2O═2HNO3+NO相同,故C正确;
D、5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O,此反应中Mn由+7价被还原为+2价,S元素由-2价升高到0价,被氧化,与3NO2+H2O═2HNO3+NO不同,故D错误;
故选C.
点评 本题考查氧化还原反应,氧化还原反应自身元素发生氧化还原的有歧化反应和归中反应,题干中所给出的是歧化反应,据此即可轻松解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.有pH值相等的A、B、C、D四种一元酸的溶液各20mL,与过量镁充分反应后,产生氢气质量是D>C>B=A.
这说明:①D的酸性最强.
②A与B的酸性最强且彼此相当.
③原D反应后溶液的pH值最大.
④反应后原A和B的溶液的pH值最大;
⑤反应前D的电离程度最大,
⑥反应前四种酸的电离程度相同,其中正确的是( )
这说明:①D的酸性最强.
②A与B的酸性最强且彼此相当.
③原D反应后溶液的pH值最大.
④反应后原A和B的溶液的pH值最大;
⑤反应前D的电离程度最大,
⑥反应前四种酸的电离程度相同,其中正确的是( )
| A. | ①③⑤ | B. | ②④⑥ | C. | ①⑥ | D. | ②③ |
19.下列各项中表达正确的是( )
①水分子球棍模型:
②玛瑙的主要成分为硅酸盐
③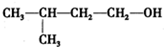 的名称是3-甲基-1-丁醇
的名称是3-甲基-1-丁醇
④聚乙烯单体结构简式为CH2=CH2
⑤HClO的结构简式为:H-Cl-O
⑥16O2与18O2互为同位素.
①水分子球棍模型:

②玛瑙的主要成分为硅酸盐
③
 的名称是3-甲基-1-丁醇
的名称是3-甲基-1-丁醇④聚乙烯单体结构简式为CH2=CH2
⑤HClO的结构简式为:H-Cl-O
⑥16O2与18O2互为同位素.
| A. | ①③④ | B. | ①⑤⑥ | C. | ③④ | D. | ④⑥ |
14.将氨水滴加到盛有AgCl的试管中直至AgCl完全溶解,对上述过程的有关解释或叙述正确的是( )
| A. | 所得溶液中c(Ag+)•c(Cl-)>Ksp(AgCl) | |
| B. | 上述实验说明Cl-与NH4+间有很强的结合力 | |
| C. | 所得溶液中形成了难电离的物质 | |
| D. | 上述过程中NH3•H2O的电离常数增大 |
11.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 铍的氧化物对应的水化物可能具有两性 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
12.下列说法正确的是( )
| A. | 凡是卤代烃一定能发生消去反应 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| D. | 苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚弱 |
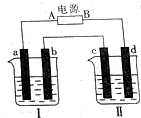 如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:
如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题: 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).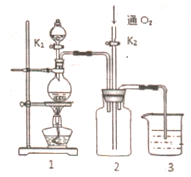 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)