7.下列描述的一定是金属元素的是( )
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
6.铝箔在空气中加热,金属熔化而不滴落的原因是( )
| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
5.对于固定体积的密闭容器中进行的气体反应A(g)+B(g)?C(s)+2D(g),可以说明在恒温下已达到平衡状态的是( )
①反应容器中压强不随时间变化而变化
②A气体和B气体的生成速率相等
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化.
①反应容器中压强不随时间变化而变化
②A气体和B气体的生成速率相等
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化.
| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①④ |
4.下列递变规律正确的是( )
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
1.进行化学实验必须注意安全,下列几种处理事故的方法正确的是( )
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干即可;
②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭;
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛;
④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火;
⑤实验时不慎打破水银温度计,立即用硫粉处理.
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干即可;
②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭;
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛;
④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火;
⑤实验时不慎打破水银温度计,立即用硫粉处理.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①③④ |
11.亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备.

已知:①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排除装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一组实验数据出现异常,造成这种异常的原因可能是ac(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)
25°C.
0 167900 167908 167914 167918 167924 167926 167930 167936 167938 167944 167950 167954 167956 167960 167966 167968 167974 167978 167980 167984 167986 167990 167992 167994 167995 167996 167998 167999 168000 168002 168004 168008 168010 168014 168016 168020 168026 168028 168034 168038 168040 168044 168050 168056 168058 168064 168068 168070 168076 168080 168086 168094 203614

已知:①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排除装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)
25°C.
 .
.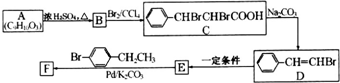
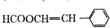 (写结构简式).
(写结构简式).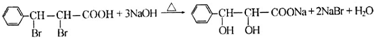
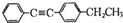 .
.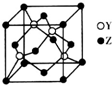 X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题: