题目内容
6.铝箔在空气中加热,金属熔化而不滴落的原因是( )| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
分析 铝属于亲氧元素,极易和空气中氧气反应生成氧化铝,氧化铝熔点很高,大于Al的熔点,一般条件下不熔融,据此分析解答.
解答 解:铝属于亲氧元素,极易和空气中氧气反应生成氧化铝,氧化铝熔点很高,大于Al的熔点,一般条件下不熔融,氧化铝膜兜住了熔化的Al而使铝不能滴落,与铝的密度等其它性质都无关,故选D.
点评 本题考查实验现象,明确铝、氧化铝的性质是解本题关键,注意从物质的熔点高低进行判断,题目难度不大.

练习册系列答案
相关题目
10.下述实验设计合理的( )
| 选项 | 实验目的 | 实验设计 |
| A | 检测溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| B | 除去CO2中的HCl | 通过饱和的NaHCO3溶液,然后干燥 |
| C | 除去乙酸乙酯中的乙酸 | 加入足量的NaOH溶液,然后分液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A. | A | B. | B | C. | C | D. | D |
7.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
1.进行化学实验必须注意安全,下列几种处理事故的方法正确的是( )
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干即可;
②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭;
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛;
④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火;
⑤实验时不慎打破水银温度计,立即用硫粉处理.
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干即可;
②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭;
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛;
④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火;
⑤实验时不慎打破水银温度计,立即用硫粉处理.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①③④ |
11.地球外层空间存在着微量的臭氧(O3)和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外辐射.可是人为的大气污染物会破坏臭氧层,如超音速飞机排放物中的氮氧化物(NO和NO2),它们和O3、O发生下列反应:O3+NO═NO2+O2;O+NO2═NO+O2,这两个反应反复循环,由此可见在反应中氮氧化物是( )
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 反应物 |
15.有关说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
16.S2Cl2在合成橡胶、硬水软化等方面有着重要应用.将Cl2通入熔融的硫黄可制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊.有关叙述正确的是( )
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
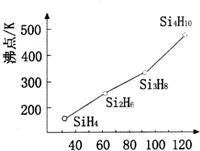 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.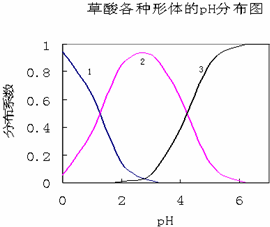 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: