10.某有机物的结构简式如图,下列关于该有机物的叙述正确的是( )
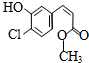

| A. | 该有机物的摩尔质量为200 | |
| B. | 该有机物属于芳香烃 | |
| C. | 该有机物可发生取代、加成、加聚、氧化、还原、消去反应 | |
| D. | 1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应 |
9.下列说法正确的是( )
| A. | 地沟油和矿物油都属于酯类物质 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 | |
| D. | 蛋白质、棉花、淀粉、油脂都是由高分子组成的物质 |
5.某研究性学习小组向一定童的NaHSO3溶液(加入少量淀粉)中加人稍过量的KIO3溶液,一段时间后.溶液突然变蓝色.为进一步研究有关因素对该反应速率的影响,探究如下.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
实验①②是探究KIO3溶液的浓度对反应速率的影响,表中t1>t2 (填“>”、“=”或“<“);
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度/ ℃ | 溶液变蓝所用 时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
| 实验步職(不要求写出具体搡作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲); 在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应, 用速率检测仪测定其起始阶段相同时间内的反应速率v(乙). | 若v(甲)=v(乙) 则假设一不成立 若v(甲)<v(乙),则假设一成立 |
4.X、Y、Z、W是原子序数依次增大的短周期元素.已知X原子的最外层电子数是其所在周期数的2倍,X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,W与Y同主族.下列说法正确的是( )
| A. | W在元素周期表中位于笫三周期笫IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的离子化合物,其阳离子与阴离子个数比不一定为2:1 |
3.下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
| 编号 | 气体 | a | b | c | 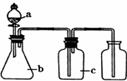 |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
| C | NO | 稀硝酸 | 铜屑 | H2O | |
| D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.卤代烃有者广泛的应用.下列说法正确的是( )
0 167891 167899 167905 167909 167915 167917 167921 167927 167929 167935 167941 167945 167947 167951 167957 167959 167965 167969 167971 167975 167977 167981 167983 167985 167986 167987 167989 167990 167991 167993 167995 167999 168001 168005 168007 168011 168017 168019 168025 168029 168031 168035 168041 168047 168049 168055 168059 168061 168067 168071 168077 168085 203614
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
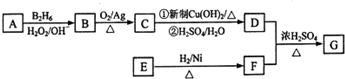
 .
.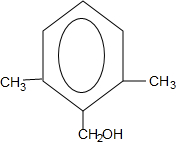 或
或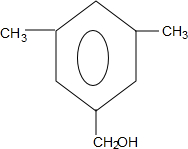 .
.
 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
