20.在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量,已知原混合溶液中FeCl3为0.4mol,则CuCl2的物质的质量不可能是( )
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
19.NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,11.2L NO和O2混合气体的原子数为NA | |
| B. | 15g甲基所含有的电子数目为9NA | |
| C. | 1L0.1mol/L的氨水溶液中含有的N原子数大于0.1NA | |
| D. | 标准状况下,6.72L NO2与水反应转移电子数为0.4NA |
17.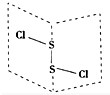 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )| A. | S2Cl2的电子式为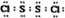 | |
| B. | 反应中SO2是还原产物,S是氧化产物 | |
| C. | S2Cl2为含有极性键和非极性键的极性分子 | |
| D. | 反应中,生成1molSO2,转移电子为3mol |
16.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

14.下列说法正确的是( )
| A. | 常温下pH=5的盐酸溶液稀释103倍后,pH等于8 | |
| B. | 浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 | |
| C. | Na2CO3溶液中存在:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的KOH溶液等体积混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
13.短周期元素R、T、X、Y、Z在元素周期表的相对位置如表所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VIA族 | |
| B. | 五种元素中原子序数最大的是X | |
| C. | 气态氢化物稳定性:T>Y | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为H2ZO4 |
12.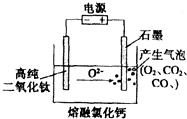 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )| A. | 阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 通电后,O2-、Cl-均向阴极移动 | |
| C. | 阴极的电极反应式为TiO2+4e-=Ti+2O2- | |
| D. | 石墨电极的质量不发生变化 |
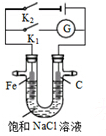
11.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )
0 167890 167898 167904 167908 167914 167916 167920 167926 167928 167934 167940 167944 167946 167950 167956 167958 167964 167968 167970 167974 167976 167980 167982 167984 167985 167986 167988 167989 167990 167992 167994 167998 168000 168004 168006 168010 168016 168018 168024 168028 168030 168034 168040 168046 168048 168054 168058 168060 168066 168070 168076 168084 203614

| A. | K1闭合,石墨棒上发生的反应为2H++2e→H2↑ | |
| B. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| C. | K2闭合,石墨棒周围溶液pH逐渐升高 | |
| D. | K1闭合,电路中通过0.004NA个电子时,石墨棒上产生0.001mol气体 |
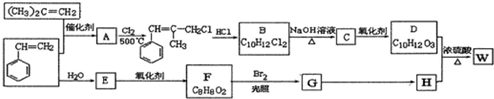
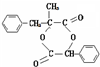 .
.  ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为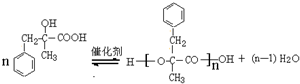 .
.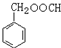 (写结构简式).
(写结构简式).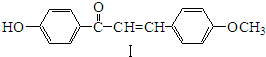

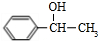 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为
,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为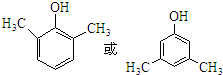 (任写一种).
(任写一种).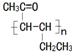 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为 ,
,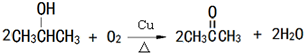 ,
, .
.