��Ŀ����
17��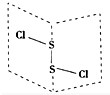 ���Ȼ���S2Cl2���ǹ㷺������ҵ����������ӽṹ����ͼ��ʾ�������£�S2Cl2��һ�ֳȻ�ɫ��Һ�壬��ˮ��ˮ�⣬��������ʹƷ����ɫ�����壮��ѧ����ʽΪ2S2Cl2+2H2O�TSO2��+3S��+4HCl������˵���д�����ǣ�������
���Ȼ���S2Cl2���ǹ㷺������ҵ����������ӽṹ����ͼ��ʾ�������£�S2Cl2��һ�ֳȻ�ɫ��Һ�壬��ˮ��ˮ�⣬��������ʹƷ����ɫ�����壮��ѧ����ʽΪ2S2Cl2+2H2O�TSO2��+3S��+4HCl������˵���д�����ǣ�������| A�� | S2Cl2�ĵ���ʽΪ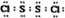 | |
| B�� | ��Ӧ��SO2�ǻ�ԭ���S���������� | |
| C�� | S2Cl2Ϊ���м��Լ��ͷǼ��Լ��ļ��Է��� | |
| D�� | ��Ӧ�У�����1molSO2��ת�Ƶ���Ϊ3mol |
���� A���ɽṹ��֪��S2Cl2������Sԭ��֮���γ�1�Թ��õ��Ӷԣ�Clԭ����Sԭ��֮���γ�1�Թ��õ��Ӷԣ�
B�����ݻ��ϼ۽���Ϊ���������ɻ�ԭ������ϼ�����Ϊ��ԭ���������������жϣ�
C��ͬ��Ԫ��ԭ��֮���γɷǼ��Լ�����ͬԪ�ص�ԭ��֮���γɵĻ�ѧ����Ϊ���Լ���S2Cl2��չ����ҳ�ͽṹ��Cl-Sλ��������ҳ���ڣ������ʽṹ���Գƣ�
D������Ԫ�صĻ��ϼ�������ȷ������ת�������
��� �⣺A���ɽṹ��֪��S2Cl2������Sԭ��֮���γ�1�Թ��õ��Ӷԣ�Clԭ����Sԭ��֮���γ�1�Թ��õ��Ӷԣ�S2Cl2�ĵ���ʽΪ 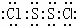 ����A��ȷ��
����A��ȷ��
B��S2Cl2�ϼ���+1����Ϊ0��������SΪ��ԭ���S2Cl2�ϼ���+1����Ϊ+4��SO2������SO2Ϊ���������B����
C��S2Cl2������S-SΪ�Ǽ��Լ���S-Cl��Ϊ���Լ���S2Cl2��չ����ҳ�ͽṹ��Cl-Sλ��������ҳ���ڣ������ʽṹ���Գƣ�����������IJ��غϣ�Ϊ���Է��ӣ���C��ȷ��
D���ڷ�Ӧ�У�SԪ�ط�������������ԭ��Ӧ��S2Cl2�ϼ���+1����Ϊ+4��SO2����������1molSO2��ת�Ƶ���Ϊ3mol����D��ȷ��
��ѡB��
���� ��S2Cl2�ĽṹΪ���壬������ӽṹ����ѧ��������ʽ��������ԭ��Ӧ�ȣ��ѶȲ����ǶԻ���֪ʶ���ۺ�������ѧ�������Ŀ��飬ע�����֪ʶ��ȫ�����գ���һ������������������Ŀ��

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�| A�� | ���� | B�� | ���� | C�� | ������̼ | D�� | ϡ������ |
| A�� | NH4HCO3��Һ�����NaOH��Һ��Ӧ��NH4++OH-=NH2��H2O | |
| B�� | �������������Һ���ն�������5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| C�� | Fe3O4��ϡHNO3��Ӧ��Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| D�� | ��������ˮ��Cl2+H2O=2H++Cl-+ClO- |
 ��ѧ����������ˮƽ����������ߣ����ִ����������Ľ��������Ĺ��������Ǵ����Ŀ���õģ���ѧ�ڹ�ҵ������Ҳռ���ž������صĵ�λ��
��ѧ����������ˮƽ����������ߣ����ִ����������Ľ��������Ĺ��������Ǵ����Ŀ���õģ���ѧ�ڹ�ҵ������Ҳռ���ž������صĵ�λ����1��N2H4-����ȼ�ϵ����һ�ּ��������أ����ڻ����͵�أ���������Ⱦ���������Һ��20%��30%��KOH��Һ���������طŵ�ʱ�������ĵ缫��Ӧʽ��O2+2H2O+4e-=4OH-�������ĵ缫��ӦʽΪN2H4+4OH--4e-=4H2O+N2����
��2���ڲ�������ʱ������Ϊ�˷�ֹŵ������������������У�����ˮ�������ܽ⣮Ȼ���ٽ��ƽ����ˮ����ȡ�������������ɽ��£���ˮ��Ũ������Ũ����Ļ��Һ�������ܽ�𡢲��Ƚ�������������ˮʱ����[PtCl4]2-��һ����ɫ���壬��������������Ϊ����ɫ��д���÷�Ӧ�����ӷ���ʽ3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO��+8H2O��
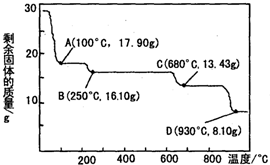
��3������п���㷺Ӧ���ڹ�ũҵ������ҽҩ����ȡ28.70g ZnSO4•7H2O��������ͬ�¶ȣ�ʣ�����������仯��ͼ��ʾ����ͼ��C�㣬680��ʱ���ù���Ļ�ѧʽΪb������ĸ��ţ���
a��ZnSO4•H2O b��Zn3O��SO4��2 c��ZnSO4 d��ZnO
��4�����ἴ�Ҷ��ᣬ��һ���л���Ԫ�ᣬ�ڹ�ҵ������Ҫ�����ã���֪��
| ���뷽��ʽ | ���볣�� |
| H2C2O4?H++HC2O4- | K1=5.4��10-2 |
| HC2O4-?H++C2O42- | K2=5.4��10-5 |
| NH3•H2O?NH4++OH- | K=1.8��10-5 |
�ڵ�������̼���Ƶ����ʵ�����2��1��ֻ�Ϻ���Һ��pH��7���뽫����Һ������Ũ�Ȱ��ɴ�С��˳������c��Na+����c��HC2O4-����c��H+����c��C2O42-����c��OH-����
��5��������ҵ��ˮ�е���Ԫ�أ�һ����������ʹ֮��ȫת����Fe3+����ת����Fe��OH��3��������ȥ����֪��ˮ��c��Fe3+��=1.0��10-2mol•L-1��Ҫ�뽫�������ȥ����Ӧ������ҺpH���ٴ���2������֪������Fe��OH��3��Knp=1.0��10-38��
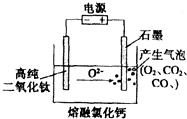 ��ͼΪEFC���ŷ��ù���������ѣ�TiO2�����������ѵ�װ��ʾ��ͼ����ԭ�����ڽϵ͵�������λ�£�TiO2���������е���������������Σ��������ֻʣ�´��ѣ�����˵������ȷ���ǣ�������
��ͼΪEFC���ŷ��ù���������ѣ�TiO2�����������ѵ�װ��ʾ��ͼ����ԭ�����ڽϵ͵�������λ�£�TiO2���������е���������������Σ��������ֻʣ�´��ѣ�����˵������ȷ���ǣ�������| A�� | �����ĵ缫��ӦʽΪ��2Cl--2e-=Cl2�� | |
| B�� | ͨ���O2-��Cl-���������ƶ� | |
| C�� | �����ĵ缫��ӦʽΪTiO2+4e-=Ti+2O2- | |
| D�� | ʯī�缫�������������仯 |
| A�� | ���ȴ������з��ӽṹΪ�����������CH2Cl2 | |
| B�� | �ȴ������ڳ����¾�ΪҺ�� | |
| C�� | ��ϩ��������ȡ1��2-����������Ҵ���ǰ��Ϊ�ӳɷ�Ӧ������Ϊˮ�ⷴӦ | |
| D�� | �����������������飨CF3CHClBr����ͬ���칹����3�֣������������칹�� |
| A�� | �ع��ͺͿ����Ͷ������������� | |
| B�� | ��ʳƷ���з���ʢ�й轺�����۵���С�����ɷ�ֹʳ���ܳ����������� | |
| C�� | Ϊ�ⶨ�����������Ƶĵ����ԣ����������ƹ������ʯӢ�����м����ۻ� | |
| D�� | �����ʡ��������ۡ���֬�����ɸ߷�����ɵ����� |
| ѡ�� | ʵ��Ŀ�� | ���� |
| A | ��ʳ��ˮ�л��NaCl���� | �������������ƾ��� |
| B | ��ϡH2SO4��Na2CO3��Һ�Ƚ�Ԫ��S��C�ķǽ�����ǿ�� | �Թܡ���ͷ�ι� |
| C | ��8.0mol��L-1���������� 250mL1.5mol��L-1������ | 250m����ƿ�����������ձ� |
| D | �ⶨNaOH��Һ�����ʵ���Ũ�� | �ᣨ�ʽ�ζ��ܣ���ͷ�ιܡ���ƿ���ձ� |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | ʯ�͵ķ���ú�ĸ��������Һ��������������仯 | |
| B�� | ���·����ޡ��顢��˿����Ҫ�ɷֶ�����ά�� | |
| C�� | �������м��˵�������ʹ�����ʷ����۳�����ˮ�������ܽ� | |
| D�� | ��ϩ������ϩ������ͨ���Ӿ۷�Ӧ�õ��߷��ӻ����� |