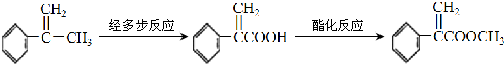题目内容
14.下列说法正确的是( )| A. | 常温下pH=5的盐酸溶液稀释103倍后,pH等于8 | |
| B. | 浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 | |
| C. | Na2CO3溶液中存在:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的KOH溶液等体积混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
分析 A.酸无限稀释不能变成碱溶液或中性溶液,只能是接近中性溶液;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.常温下,pH=2的醋酸溶液浓度大于pH=12的KOH溶液,二者等体积混合,醋酸有剩余,溶液呈酸性,溶液中存在电荷守恒.
解答 解:A.酸无限稀释不能变成碱溶液或中性溶液,只能是接近中性溶液,所以常温下pH=5的盐酸稀释100倍时溶液pH接近7,故A错误;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,一水合氨抑制水电离、氯化铵促进水电离,所以水电离出的c(H+)前者小于后者,故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故C错误;
D.常温下,pH=2的醋酸溶液浓度大于pH=12的KOH溶液,二者等体积混合,醋酸有剩余,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒得c(K+)+c(H+)=c(OH-)+c(CH3COO-),故D正确;
故选BD.
点评 本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,利用电荷守恒、物料守恒判断,易错选项是A,酸或碱无限稀释接近中性时要考虑水的电离.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.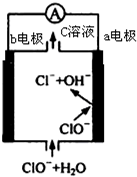 镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
 镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )| A. | 电池工作时,C溶液中的溶质是MgCl2 | |
| B. | 电池工作时,正极a附近的PH将不断增大 | |
| C. | 负极反应式:ClO --2e -+H2O═Cl-+2 OH- | |
| D. | b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl- |
5.某研究性小组探究乙酸乙酯的反应机理,相关物理性质(常温常压)及仪器如下:
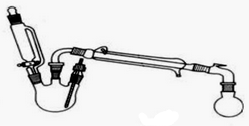
已知:当乙酸乙酯安装物质的量1:1投料时,乙酸的转化率为65%,当乙酸和乙醇按照物质的量1:10投料时,乙酸的转化率为97%(数据均在120℃下测定).
实验过程:
Ⅰ.合成反应:在三颈烧瓶中加入乙醇5mL,浓硫酸5mL,2小片碎瓷片.漏斗加入乙酸14.3 mL,乙醇20 mL.冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120℃.
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾.最终通过蒸馏得到纯净的乙酸乙酯.
回答下列问题:
(1)酯化反应的机理探究
A、乙醇羟基氧示踪
CH2CO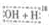 OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
B、用醋酸烃基氧示踪

实验B发现,产物中含氧-18水占到总水量的一半,酯也一样.这个实验推翻了酯化反应为简单的取代反应的结论.请你设想酯化反应的机理先加成反应生成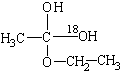 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成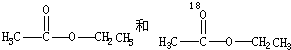 .
.
(2)酯化反应是一个可逆的反应,120℃时,平衡常数K=3.45.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验用到的量取液体体积的仪器是量筒,浓硫酸与乙醇混合应怎样操作?先加入乙醇后加入硫酸,边振荡加滴加.
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(6)蒸出的粗乙酸乙酯中主要有哪些杂质乙醚、乙酸、乙醇和水.用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |

已知:当乙酸乙酯安装物质的量1:1投料时,乙酸的转化率为65%,当乙酸和乙醇按照物质的量1:10投料时,乙酸的转化率为97%(数据均在120℃下测定).
实验过程:
Ⅰ.合成反应:在三颈烧瓶中加入乙醇5mL,浓硫酸5mL,2小片碎瓷片.漏斗加入乙酸14.3 mL,乙醇20 mL.冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120℃.
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾.最终通过蒸馏得到纯净的乙酸乙酯.
回答下列问题:
(1)酯化反应的机理探究
A、乙醇羟基氧示踪
CH2CO
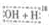 OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2OB、用醋酸烃基氧示踪

实验B发现,产物中含氧-18水占到总水量的一半,酯也一样.这个实验推翻了酯化反应为简单的取代反应的结论.请你设想酯化反应的机理先加成反应生成
 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成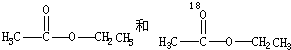 .
.(2)酯化反应是一个可逆的反应,120℃时,平衡常数K=3.45.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验用到的量取液体体积的仪器是量筒,浓硫酸与乙醇混合应怎样操作?先加入乙醇后加入硫酸,边振荡加滴加.
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(6)蒸出的粗乙酸乙酯中主要有哪些杂质乙醚、乙酸、乙醇和水.用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
2.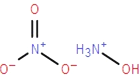 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵是离子化合物 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
19.NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,11.2L NO和O2混合气体的原子数为NA | |
| B. | 15g甲基所含有的电子数目为9NA | |
| C. | 1L0.1mol/L的氨水溶液中含有的N原子数大于0.1NA | |
| D. | 标准状况下,6.72L NO2与水反应转移电子数为0.4NA |
3.乙酸橙花酯是一种食用香料,其结构简式如图所示.下列关于该有机物的叙述中不正确的是( )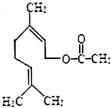

| A. | 分子式为C12H20O2 | |
| B. | 能发生加成反应、取代反应、氧化反应 | |
| C. | 1mol该有机物在一定条件下能和3mol H2发生反应 | |
| D. | 该有机物仅含有两种不同类型的官能团 |
4.下列实验装置和试剂的选用或操作都正确的是( )
| A. | 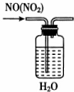 除去NO中的NO2 | B. | 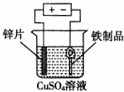 铁制品表面镀锌 | C. | 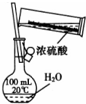 稀释浓硫酸 | D. | 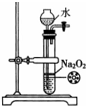 制备少量O2 |

 ;反应③
;反应③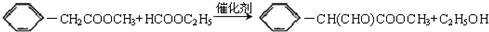 .
.