9.高炉炼铁过程中发生的主要反应为:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数列于表中:
(1)写出该反应的平衡常数表达式:K=$\frac{[C{O}_{2}]^{3}}{[CO]^{3}}$.
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0mol,反应经过l0min后达到平衡.求该时间范围内反应的平均反应速率υ(CO2)=0.008mol•L-1•min-1;平衡时,c(CO)=0.02mol/L.
(3)欲提高(2)中CO的反应速率,可采取的措施是DEF.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的体积 F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是A.
(5)铁是国家的工业基础,下列哪些装置可防止铁棒被腐蚀BD.

| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.653 | 42.875 |
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0mol,反应经过l0min后达到平衡.求该时间范围内反应的平均反应速率υ(CO2)=0.008mol•L-1•min-1;平衡时,c(CO)=0.02mol/L.
(3)欲提高(2)中CO的反应速率,可采取的措施是DEF.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的体积 F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是A.
| A | B | C | D | |
| n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
| n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
| n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
| n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |

8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
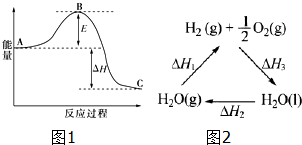
(2)合成氨反应:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),反应过程的能量变化如图1所示.已知N2(g)与H2(g)反应生成34gNH3(g),放出92.2kJ的热量.请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”),图中△H=-46.1kJ/mol
(3)由气态基态原子形成1mol化学键释放的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJ•mol-1.试根据表中所列键能数据估算a 的值:-93.
(4)已知:△H2=+44kJ•mol-1,△H3=-285.8kJ•mol-1图2列出它们之间的转变关系.请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=-(△H2+△H3)(用△H2、△H3表示△H1计算等式),+241.8kJ•mol-1(计算△H1数据结果).
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
(2)合成氨反应:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),反应过程的能量变化如图1所示.已知N2(g)与H2(g)反应生成34gNH3(g),放出92.2kJ的热量.请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”),图中△H=-46.1kJ/mol
(3)由气态基态原子形成1mol化学键释放的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(4)已知:△H2=+44kJ•mol-1,△H3=-285.8kJ•mol-1图2列出它们之间的转变关系.请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=-(△H2+△H3)(用△H2、△H3表示△H1计算等式),+241.8kJ•mol-1(计算△H1数据结果).

7.美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是( )
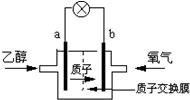

| A. | a极为电池的负极,乙醇被还原 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-=H2O | |
| D. | 电池工作时1mol乙醇被氧化时,就有12mol质子通过质子交换膜 |
6.用铂电极电解100mL HNO3与AgNO3 的混合液,通电一段时间后,两极均收集到2.24L 气体(标准状况下),则原混合液中c(Ag+)为( )
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |
5.能增加反应物分子的活化分子的百分数,同时可以改变化学平衡常数的是( )
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大压强 | D. | 增加浓度 |
4.高温下,炽热的铁与水蒸气在一个密闭的容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
| A. | 把铁块换成铁粉 | |
| B. | 将容器的体积压缩至原体积的一半 | |
| C. | 若保持压强不变,充入氮气使容器的体积增大 | |
| D. | 若保持体积不变,充入氮气使容器内的压强增大 |
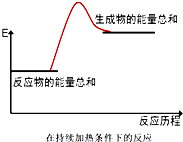
3.下列反应符合图示的是( )
0 167822 167830 167836 167840 167846 167848 167852 167858 167860 167866 167872 167876 167878 167882 167888 167890 167896 167900 167902 167906 167908 167912 167914 167916 167917 167918 167920 167921 167922 167924 167926 167930 167932 167936 167938 167942 167948 167950 167956 167960 167962 167966 167972 167978 167980 167986 167990 167992 167998 168002 168008 168016 203614

| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 合成氨的反应 | D. | 碳酸钙的分解反应 |
 请按要求回答下列问题.
请按要求回答下列问题.
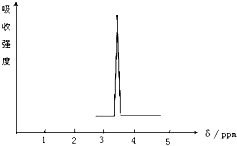 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号). 乙苯
乙苯