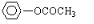题目内容
10.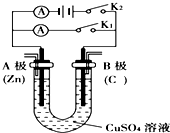 请按要求回答下列问题.
请按要求回答下列问题.(1)根据图回答①②.
①打开K2,闭合K1.A极电极反应式为Zn-2e-=Zn2+,B极的现象在碳棒上析出红色的铜.
②B极重新换根碳棒,再打开K1,闭合K2.B极电极反应式4OH--4e-=O2↑+2H2O.装置发生的总反应化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.实验完成后,锌电极增重a g,则阳极产生标准状况下的气体体积0.175aL
(2)改变两电极的电极材料,利用该装置要实现Cu+H2SO4═CuSO4+H2↑反应的发生,应打开K1闭合K2,其电解质溶液需用硫酸溶液,B电极材料是用铜棒,A电极反应式为2H++2e-=H2↑.
分析 (1)①若断开K2,闭合K1,形成原电池反应,Zn为负极,被氧化,Cu为正极,发生还原反应生成铜;
②若断开K1,闭合K2,为电解池,C为阳极,Zn为阴极,该极上析出金属铜,根据电极反应书写总反应,根据电子守恒进行计算;
(2)要实现反应Cu+H2SO4═CuSO4+H2↑发生,则金属铜是阳极,硫酸是电解质,阴极材料是比铜活泼性差的金属或非金属,据此回答.
解答 解:(1)①若断开K2,闭合K1,形成原电池反应,Zn为负极,被氧化而锌不断溶解,Zn-2e-=Zn2+,Cu为正极,发生还原反应生成铜,电极方程式为Cu2++2e-═Cu,有红色物质析出,
故答案为:Zn-2e-=Zn2+;在碳棒上析出红色的铜;
②若断开K1,闭合K2,为电解池,C为阳极,发生电极反应:4OH--4e-=2H2O+O2↑,Zn为阴极,该极上析出金属铜,发生Cu2++2e-═Cu,总反应是:电解2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,Zn为阴极发生Cu2++2e-═Cu,锌电极增重ag即$\frac{a}{64}$molCu生成,转移电子是$\frac{a}{32}$mol,阳极发生电极反应:4OH--4e-=2H2O+O2↑,生成的氧气体积是:$\frac{a}{32}$××$\frac{1}{4}$22.4L/mol=0.175aL,
故答案为:4OH--4e-=O2↑+2H2O;2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;0.175a;
(2)要实现反应Cu+H2SO4═CuSO4+H2↑发生,则金属铜失电子,是阳极,阴极上是氢离子得电子的还原反应,即2H++2e-=H2↑,硫酸是电解质,阴极材料是比铜活泼性差的金属或非金属,此时要形成电解池,应打开K1闭合K2,
故答案为:K1; K2; 硫酸溶液; 铜棒;2H++2e-=H2↑.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析、计算能力的考查,知道原电池和电解池区别,知道各个电极上发生的电极反应,再结合各个物理量之间的关系式计算,题目难度不大.

| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |

| A. | 分子中至少有12个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大压强 | D. | 增加浓度 |
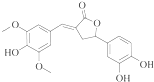
| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol该化合物最多能与6molNaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 既能与FeC13发生显色反应,也能和Na2CO3反应 |
| A. | SO2 | B. | NH3 | C. | N2 | D. | CO2 |
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性: Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
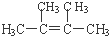 ;
;

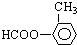 还有:
还有: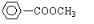 .
.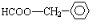 .
.