题目内容
8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
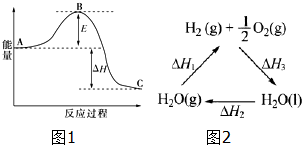
(2)合成氨反应:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),反应过程的能量变化如图1所示.已知N2(g)与H2(g)反应生成34gNH3(g),放出92.2kJ的热量.请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”),图中△H=-46.1kJ/mol
(3)由气态基态原子形成1mol化学键释放的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(4)已知:△H2=+44kJ•mol-1,△H3=-285.8kJ•mol-1图2列出它们之间的转变关系.请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=-(△H2+△H3)(用△H2、△H3表示△H1计算等式),+241.8kJ•mol-1(计算△H1数据结果).
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)依据催化剂降低反应的活化能加快反应速率分析;结合已知N2(g)与H2(g)反应生成34g NH3(g),放出92.2kJ的热量,分析图象是合成氨反应N2(g)+3H2(g)=2NH3(g),计算得到;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;
(4)根据图2写出反应2和反应3的热化学方程式,然后根据盖斯定律来分析.
解答 解:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,
则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol,
故答案为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol;
(2)催化剂降低反应的活化能加快反应速率,则加催化剂会使图中E变小;已知N2(g)与H2(g)反应生成34g NH3(g),放出92.2kJ的热量,图象是表示的是反应$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)能量变化,由于生成34g氨气放热92.2kJ,则生成17g氨气时放热46.1KJ,故热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.1kJ/mol,
故答案为:小;-46.1kJ/mol;
(3)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-391kJ•mol-1×6=-93kJ•mol-1=a kJ•mol-1,因此a=-93,故答案为:-93;
(4)根据图2可知:H2O(l)=H2O(g)△H2=+44kJ•mol-1②
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ•mol-1③
将-③-②可得:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H1=-(△H2+△H3)=-[(-285.8kJ•mol-1)+(+44kJ•mol-1)]=+241.8kJ•mol-1,
故答案为:-(△H2+△H3);+241.8kJ•mol-1.
点评 本题考查了热化学方程式书写方法和盖斯定律的计算应用等,焓变可以用反应物总键能-生成物总键能计算,题目难度中等.

 智慧小复习系列答案
智慧小复习系列答案| A. | 石油分馏 | B. | 碘片升华 | C. | 食盐熔化 | D. | 煤的干馏 |
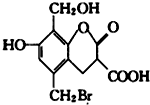 某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )
某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )| A. | 3:4:2 | B. | 3:5:2 | C. | 3:5:1 | D. | 3:4:1 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 合成氨的反应 | D. | 碳酸钙的分解反应 |
| A. | 加成→消去→取代 | B. | 消去→加成→消去 | C. | 消去→加成→取代 | D. | 取代→消去→加成 |
| A. | 将SO2气体通入含有氢氧化钠的酚酞溶液中,溶液褪色 | |
| B. | 将SO2气体通入澄清石灰水中,溶液变浑浊 | |
| C. | 将SO2通入品红溶液中,溶液褪色 | |
| D. | 将SO2气体通入碘水溶液中,溶液褪色 |
| A. | CO2和NaOH溶液 | B. | NO2和水 | C. | NH3和水 | D. | Cl2和NaOH溶液 |
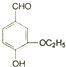 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.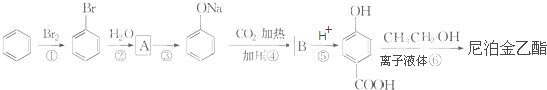
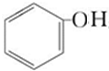 ,B
,B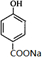 ;
;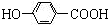 +CH3CH2OH$→_{△}^{离子液体}$
+CH3CH2OH$→_{△}^{离子液体}$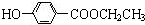 +H2O.
+H2O.