7.形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是( )
| A. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| C. | 在农村推广使用沼气 | |
| D. | 减少资源消耗、增加资源的重复使用和资源的循环再生 |
2.下列气体的收集用错装置的是( )
| A. | 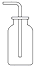 Cl2的收集 | B. | 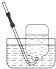 HCl的收集 | C. |  NH3的收集 | D. | 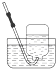 NO的收集 |
1.在恒温下的密闭容器中,有可逆反应:2NO(g)+O2(g)?2NO2(g)(反应放热),能说明已达到平衡状态的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 单位时间内生成1mol O2的同时,生成1molNO |
20.(1)25℃下,0.1mol/L醋酸pH为4,则此温下,该浓度醋酸的电离度为0.1%;电离平衡常数为10-7,水电离出的c(H+)=10-10mol/L,加少量水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小(填“增大”或“减小”)
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
试回答下列问题:
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是$\frac{7}{2}$<a<$\frac{14}{3}$.
0 167766 167774 167780 167784 167790 167792 167796 167802 167804 167810 167816 167820 167822 167826 167832 167834 167840 167844 167846 167850 167852 167856 167858 167860 167861 167862 167864 167865 167866 167868 167870 167874 167876 167880 167882 167886 167892 167894 167900 167904 167906 167910 167916 167922 167924 167930 167934 167936 167942 167946 167952 167960 203614
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是$\frac{7}{2}$<a<$\frac{14}{3}$.

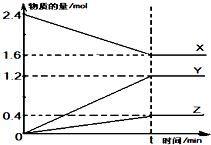 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.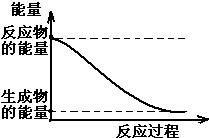 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填