题目内容
6.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: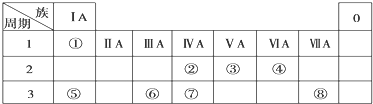
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价氧化物对应水化物的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)写出⑥的最高价氧化物对应水化物分别与⑤、⑧的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O.
(4)由表中①、④两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)A.
A.MnO2 B.NaCl C.Na2SO3 D.KMnO4.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)元素的非金属性越强,最高价氧化物对应水化物的酸性;
(3)⑥的最高价氧化物对应水化物为Al(OH)3,⑤、⑧的最高价氧化物对应水化物分别为NaOH、HClO4,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,与高氯酸反应生成 高氯酸铝与水;
(4)表中①、④两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2等催化剂作用下发生分解反应.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,
故答案为:Na>Al>O;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则酸性:HClO4HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)⑥的最高价氧化物对应水化物为Al(OH)3,⑤、⑧的最高价氧化物对应水化物分别为NaOH、HClO4,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,与高氯酸反应生成 高氯酸铝与水,离子方程式分别为:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O;
(4)表中①、④两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2等催化剂作用下发生分解反应,过氧化氢具有氧化性、还原性,可以氧化亚硫酸钠,可以被高锰酸钾氧化,故选:A.
点评 本题以元素周期表为题材,考查原子半径比较、酸性强弱、离子方程式等,注意对元素周期表和周期律的理解掌握,比较基础.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | 可根据同周期元素的第一电离能变化规律,推出Al的第一电离能比Mg大 | |
| B. | 结构和组成相似的分子晶体,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据溶解度小的沉淀易向溶解度更小的沉淀转化的规律,推出在ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 芳香烃属于碳氢化合物 | ||
| C. | 乙炔是含碳量最高的碳氢化合物 | D. | 溴苯属于碳氢化合物 |
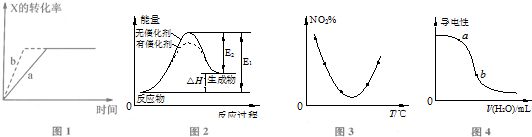
| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 单位时间内生成1mol O2的同时,生成1molNO |
①增加X ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把绿豆大的钾投入少量水中 | |
| C. | 把一段打磨过的镁带放入少量冷水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
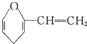 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
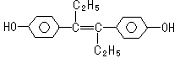
| A. | 该药物可以用有机溶剂萃取 | |
| B. | 该有机物可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |