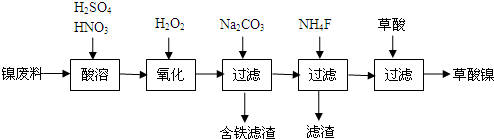
7.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | NA个氢氧化铁胶粒的质量为107g | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 在密闭容器中,0.5molH2和0.5molN2充分反应后得不到NA个NH3分子 |
6.室温下下列各组离子或分子在指定的溶液中一定能大量共存的是( )
| A. | c(H+)=c(OH-)的溶液中:SO42-、Na+、Cl-、Fe3+ | |
| B. | 在c(HCO3-)=0.1mol•L-1的溶液中:[Al(OH)4]-、Na+、NO3-、C6H5O- | |
| C. | 饱和氯水中:K+、Mg2+、CH3COO-、SO42- | |
| D. | 能使酚酞变红的溶液:Ba2+、NO3-、I-、Na+ |
5.汽车在剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,下列关于该反应的说法正确的是( )
| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
4.表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ).
根据上述数据回答(1)~(5)题:
(1)下列物质本身具有的能量最低的是A (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D)
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是Cl2(填写分子式).
(5)若无上表中的数据,你能正确回答出问题(4)吗?能.(填能、否)你的根据是元素的非金属性越强,生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定,放出的热量多.
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl HBr HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 366 298 |
(1)下列物质本身具有的能量最低的是A (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D)
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是Cl2(填写分子式).
(5)若无上表中的数据,你能正确回答出问题(4)吗?能.(填能、否)你的根据是元素的非金属性越强,生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定,放出的热量多.
3.下列叙述正确的是( )
| A. | 非极性键不可能存在于离子化合物中 | |
| B. | 制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 | |
| C. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| D. | 单质分子中均不存在化学键 |
19.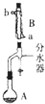 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
(1)制备乙酸正丁酯
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
0 167758 167766 167772 167776 167782 167784 167788 167794 167796 167802 167808 167812 167814 167818 167824 167826 167832 167836 167838 167842 167844 167848 167850 167852 167853 167854 167856 167857 167858 167860 167862 167866 167868 167872 167874 167878 167884 167886 167892 167896 167898 167902 167908 167914 167916 167922 167926 167928 167934 167938 167944 167952 203614
 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.

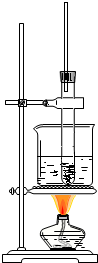 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下: