题目内容
5.汽车在剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,下列关于该反应的说法正确的是( )| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
分析 A.氮气的结构为N≡N,含1个σ键、2个π键;
B.非电解质为化合物;
C.硝酸钾中N元素的化合价由+5价降低为0;
D.钠离子与N3-形成离子键,阴离子中存在N元素之间的共价键.
解答 解:A.氮气的结构为N≡N,含1个σ键、2个π键,则22.4LN2中σ键与π键个数比为1:2,故A正确;
B.非电解质为化合物,氮气既不是电解质也不是非电解质,故B错误;
C.硝酸钾中N元素的化合价由+5价降低为0,则该反应每转移1mol电子,有0.2molKNO3被还原,故C错误;
D.NaN3是含有离子键和非极性共价键的离子化合物,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,将N3-作为整体来分析为解答的难点,选项A中与体积无关,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
6.某单官能团有机物的分子式为C3H6O,它可能的结构共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
16.某石油化工产品X的转化关系如图,下列判断不正确的是( )


| A. | X能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| B. | Y与乙酸反应生成W的反应类型是取代反应 | |
| C. | Z和Y分子中官能团不同 | |
| D. | W的分子式为C4H8O2 |
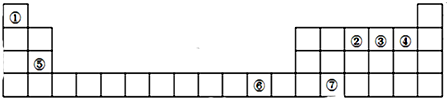
13.如图是元素周期表的一部分,下列说法中,正确的是( )


| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:⑤>③ | ||
| C. | 元素的最高正化合价:④=② | D. | 最高价氧化物对应水化物酸性:⑤>④ |
10. 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 品红溶液 | 溶液褪色 | SO2 有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | C2H4能发生加成反应 |
| C | NH3 | 酚酞试液 | 溶液变红 | 氨水具有漂白性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
17.将一定量的Cl2通入30mL10.00 mol•L-1的浓KOH溶液中,适当加热使溶液中形成KCl、KClO、KClO3共存体系,下列有关说法错误的是 ( )
| A. | 溶液中n(KCl)=n(KClO)+5n(KClO3) | |
| B. | 参加反应的氯气的物质的量一定为0.15mol | |
| C. | 若反应中转移电子为nmol,则0.15mol<n<0.25mol | |
| D. | 共存体系溶液中,n(K+)、n(Cl-)可能为7:3 |
15.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应的化学方程式为CO+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO2+H2 | |
| B. | 该反应的焓变为正值 | |
| C. | 恒温恒容下,充入氮气,平衡右移 | |
| D. | 升高温度,逆反应速率减小 |