6.利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
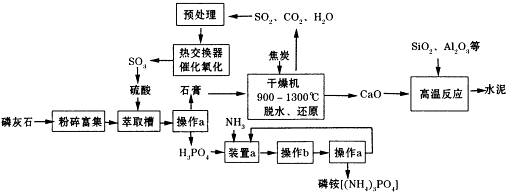
(1)D操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)在实验室中操作b包括蒸发结晶、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十02(g)?2S03(g).实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%).
①实际生产中,S02的催化氧化反应是在常压、400℃-500℃条件下进行.采用常压的主要原因是常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;该反应化学平衡常数大小关系是:K(400℃)>K(500℃)(填“>”、“<”或“=”).
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是CD.(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液 c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸.

(1)D操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)在实验室中操作b包括蒸发结晶、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十02(g)?2S03(g).实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%).
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是CD.(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液 c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸.
3.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:

已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①需要加快反应速率,措施有充分搅拌和加热、适当增加盐酸浓度等(写一种).碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是A
A.50~60℃B.80~100℃C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.
0 167752 167760 167766 167770 167776 167778 167782 167788 167790 167796 167802 167806 167808 167812 167818 167820 167826 167830 167832 167836 167838 167842 167844 167846 167847 167848 167850 167851 167852 167854 167856 167860 167862 167866 167868 167872 167878 167880 167886 167890 167892 167896 167902 167908 167910 167916 167920 167922 167928 167932 167938 167946 203614

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①需要加快反应速率,措施有充分搅拌和加热、适当增加盐酸浓度等(写一种).碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是A
A.50~60℃B.80~100℃C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.