题目内容
11.Cu-Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),现进行如下实验(以下气体体积均在标况下测得)①将此合金块5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体为672mL,过滤得绿色溶液A,还有滤渣B.
②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO、NO2混合气体896mL,经测定(标况下)此混合气体与氢气的相对密度为17.
③将①中所得滤液加入到同浓度足量的HNO3中,用排水法收集一烧瓶气体,再向烧瓶中通入224mL O2,气体恰好完全溶于水.
(1)A中存在的阳离子有Fe2+、H+;
(2)896mL混合气体中NO、NO2的物质的量之比为3:1;
(3)B的单质为Cu,质量为3.2g;
(4)③中被HNO3氧化了的阳离子的物质的量为0.04mol;
(5)此合金块中氧元素的质量为0.32g.
分析 (1)溶液呈绿色说明含有亚铁离子,溶液呈酸性,还含有氢离子;
(2)Cu不溶于稀硫酸,则滤渣B为铜,铜和硝酸反应生成氮氧化物NO、NO2,根据混合气体密度为1.52g/L,求出混合气体的平均摩尔质量,利用十字相乘法确定一氧化氮和二氧化氮的物质的量之比;
(3)Cu不溶于稀硫酸,则滤渣B为铜,根据NO和NO2的物质的量,利用转移电子守恒计算铜的物质的量和质量;
(4)Fe2+与HNO3反应生成NO,反应中Fe元素失去电子,N元素得电子,生成的NO与水、氧气反应,NO又失电子,氧气得电子,整个过程中转移的电子守恒,据此计算;
(5)该合金中含有Cu、Fe和O三种元素,根据(3)(4)可知Cu、Fe的质量,然后计算O的质量.
解答 解:(1)溶液呈绿色说明含有亚铁离子,溶液呈酸性,所以还含有氢离子,酸过量,则滤渣只含铜,
故答案为:Fe2+、H+;
(2)B中滤渣是铜,铜和硝酸反应生成氮氧化物,NO、NO2混合气体896mL,经测定(标况下)此混合气体密度为1.52g/L,则混合气体的平均摩尔质量=1.52g×22.4g/L=34g/mol,利用十字相乘法确定一氧化氮和二氧化氮的物质的量之比: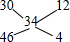 ,所以一氧化氮和二氧化氮的物质的量之比=12:4=3:1,
,所以一氧化氮和二氧化氮的物质的量之比=12:4=3:1,
故答案为:3:1;
(3)氮氧化合物的物质的量=$\frac{0.896L}{22.4L/mol}$=0.04mol,已知一氧化氮和二氧化氮的物质的量之比3:1,则一氧化氮的物质的量是0.03mol,二氧化氮的物质的量是0.01mol,根据转移电子守恒得铜的物质的量=$\frac{(0.03×3+0.01×1)mol}{2}$=0.05mol,所以m(Cu)=0.05mol×64g/mol=3.2g;
故答案为:3.2;
(4)Fe2+与HNO3反应生成NO,反应中Fe元素失去电子,N元素得电子,生成的NO与水、氧气反应,NO又失电子,氧气得电子,整个过程中转移的电子守恒,
已知n(O2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则氧气得到的电子为n(电子)=0.01mol×4=0.04mol,所以Fe2+失去的电子的物质的量也是0.04mol,1molFe2+反应失去1mol电子,所以n(Fe2+)=0.04mol;
故答案为:0.04;
(5)该合金中含有Cu、Fe和O三种元素,由(3)可知Cu的质量为3.2g,由(4)可知m(Fe)=nM=0.04mol×56g/mol=2.24g,
则O元素的质量为5.76g-3.2g-2.24g=0.32g,
故答案为:0.32.
点评 本题考查了铁的性质、氧化还原反应的有关计算,明确物质间的反应是解本题关键,结合原子守恒、转移电子守恒来分析解答即可,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 将溴乙烷与NaOH溶液混合后振荡、静置,直接向反应后的混合物中滴加AgNO3溶液,检验Br-的存在 | |
| B. | 将乙醇加热至170℃,制取乙烯 | |
| C. | 向试管中加入5 mL溴水、2 mL苯和0.5 g铁粉,充分振荡后静置,观察试管底部生成的褐色油状液体 | |
| D. | 在试管中加入约2 mL饱和溴水,然后滴入2滴~3滴苯酚稀溶液,观察苯酚与溴反应生成的白色沉淀 |
| A. | 431 kJ•mol-1 | B. | 945.6 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
| A. | 10种 | B. | 12种 | C. | 15种 | D. | 18种 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 品红溶液 | 溶液褪色 | SO2 有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | C2H4能发生加成反应 |
| C | NH3 | 酚酞试液 | 溶液变红 | 氨水具有漂白性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
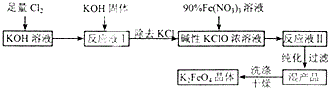 高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:
高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下: