18.醋酸钡[(CH3COO)2Ba•H2O]是一种媒染剂,下列是有关0.1mol/L醋酸钡溶液中粒子浓度的比较,其中错误的是( )
| A. | c(H+)=c(OH-)-c(CH3COOH) | B. | c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
16.下列描述的过程中的能量变化与如图一致的是( )
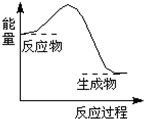

| A. | 反应物总键能比生成物总键能大 | B. | H-H键断裂 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
15.下列说法正确的是( )
| A. | HCl比H2S稳定 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 离子键的本质是带相反电荷的阴、阳离子的相互吸引 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
14.如表是不同温度下水的离子积数据:
若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
13.下列说法不正确的是( )
| A. | 常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 | |
| B. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| C. | 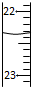 滴定达终点时,图滴定管的正确读数为23.65 mL 滴定达终点时,图滴定管的正确读数为23.65 mL | |
| D. | 温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变 |
12.下列图示与对应的叙述相符的是( )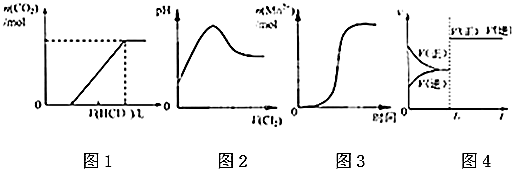

| A. | 图①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图②表示0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1HCl溶液所得到的滴定曲线 | |
| C. | 图③表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 | |
| D. | 图④表示某可逆反应生成物的量随反应时间变化的曲线,由图t时反应物转化率最大 |
11.甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.
| A. | ①②③ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①② |
10.短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
9.外围电子构型为4d55s1的元素在周期表中的位置是( )
0 167732 167740 167746 167750 167756 167758 167762 167768 167770 167776 167782 167786 167788 167792 167798 167800 167806 167810 167812 167816 167818 167822 167824 167826 167827 167828 167830 167831 167832 167834 167836 167840 167842 167846 167848 167852 167858 167860 167866 167870 167872 167876 167882 167888 167890 167896 167900 167902 167908 167912 167918 167926 203614
| A. | 第4周期第ⅠB族 | B. | 第5周期第ⅠB族 | C. | 第4周期第ⅥB族 | D. | 第5周期第ⅥB族 |
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. .
.