6.某无色溶液,只可能含有下表中的几种离子.
进行如下实验分析其组成:
①取10mL该溶液试管中,滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色产生乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,气体丙逸出,将收集的气体丙的体积换算成标准状况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
①取10mL该溶液试管中,滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色产生乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,气体丙逸出,将收集的气体丙的体积换算成标准状况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
5.氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
①T3℃时,该反应的平衡常数K=0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
| 浓度/mol.L-1 | NO | N2 | CO2 |
| 时间/min | |||
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.30 | 0.030 |
| 30 | 0.040 | 0.30 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).
2.下列各组物质中属于同分异构体的是( )
| A. | 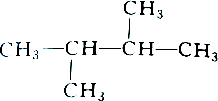 和 和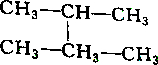 | B. | 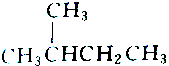 和 和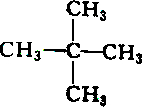 | ||
| C. | 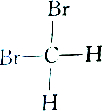 和 和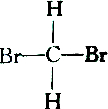 | D. | 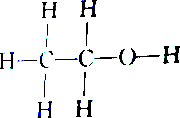 和 和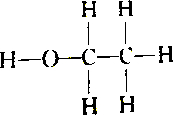 |
13.实验室在2L的密闭容器里加入0.1molCO和0.1molNO,在T℃进行反应,有关数据记录如表:
(1)0~10s内用N2表示该反应的平均反应速率为0.0015mol/(L•s);
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
| 时间/s | 5 | 10 | 15 | 20 | 25 |
| n(CO2)/mol | 0.04 | 0.06 | 0.07 | 0.08 | 0.08 |
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )
0 167697 167705 167711 167715 167721 167723 167727 167733 167735 167741 167747 167751 167753 167757 167763 167765 167771 167775 167777 167781 167783 167787 167789 167791 167792 167793 167795 167796 167797 167799 167801 167805 167807 167811 167813 167817 167823 167825 167831 167835 167837 167841 167847 167853 167855 167861 167865 167867 167873 167877 167883 167891 203614
| A. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | NH4Cl溶于重水(D2O)生成NH3D2O和HD2O+ | |
| D. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
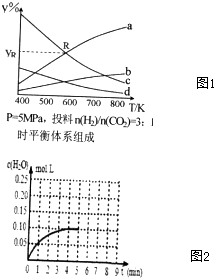 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.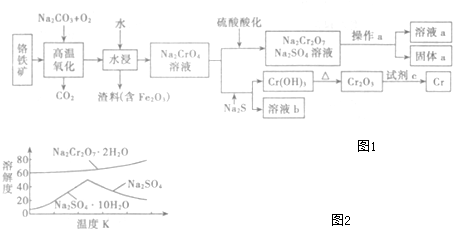
 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等. 工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示:
工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示: