题目内容
6.某无色溶液,只可能含有下表中的几种离子.| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
①取10mL该溶液试管中,滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色产生乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,气体丙逸出,将收集的气体丙的体积换算成标准状况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
分析 溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+为0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+;则一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、HCO3-.
解答 解:溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-,且物质的量为0.03mol;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+为0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+,且物质的量为0.03×2-0.01-0.01×3=0.02mol,综上所述可知一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、HCO3-.
A.由上述分析可知,Mg2+、HCO3-、Cl-、MnO4-一定不存在,故A正确;
B.由上述分析可知,一定含有的离子为K+,物质的量为0.02mol,故浓度为:$\frac{0.02mol}{0.01L}$=2mol/L,故B正确;
C.由推断得出铵根的物质的量等于铝离子的物质的量,故不可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液,故C错误;
D.根据实验③得出的沉淀物质只有氢氧化铝,蒸干灼烧只得到氧化铝,故D正确;故选C.
点评 本题考查物质检验的实验方案的设计,为高频考点,把握实验中现象与结论的关系、发生的离子反应为解答的关键,注意电荷守恒的应用,题目难度中等.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 溴乙烷与NaOH醇溶液共热 | B. | 甲苯与浓硫酸和浓硝酸的反应 | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 甲烷与氯气在光照的条件下反应 |
| A. | 0.1mol•L-1醋酸,溶液的pH=1 | |
| B. | 0.1mol•L-1醋酸加水稀释,溶液中离子浓度都减小 | |
| C. | 0.1mol•L-1氨水溶液中:c(OH-)=c(NH${\;}_{4}^{+}$) | |
| D. | 0.1mol•L-1氨水与0.1mol•L-1 HCl溶液等体积混合所得溶液中:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) |
| A. | 晶体硅是制造太阳能电池的常用材料 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 氢氟酸可用刻蚀玻璃 | |
| D. | 硅是制取水泥的原料 |
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 | ||
| C. | Na2O2固体中阴、阳离子 | D. | ${\;}_{1}^{2}$H原子中的质子和中子 |
| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
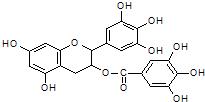 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )| A. | EGCG能与碳酸钠溶液反应放出二氧化碳 | |
| B. | EGCG遇FeCl3溶液能发生显色反应 | |
| C. | 1molEGCG最多可与含10mol NaOH的溶液完全作用 | |
| D. | EGCG在空气中易氧化 |
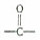 与HCN反应引入:
与HCN反应引入: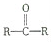 $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$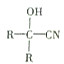
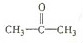 $→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D
$→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D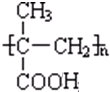 .
.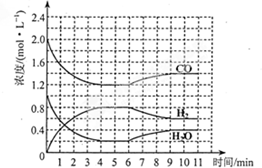 工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示:
工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示: