题目内容
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )| A. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | NH4Cl溶于重水(D2O)生成NH3D2O和HD2O+ | |
| D. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
分析 A.醋酸为弱酸,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性,则c(H+)>c(OH-),然后根据电荷守恒判断溶液中离子浓度大小;
B.混合液显示酸性,则c(H+)>c(OH-),结合电荷守恒可知c(CH3COO-)>c(Na+);
C.溶液中存在水解平衡NH4++2D2O?NH3•HDO+D3O+,据此进行分析;
D.根据碳酸钠溶液中的质子守恒判断.
解答 解:A.醋酸为弱电解质,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可得:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A错误;
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,则:c(H+)>c(OH-),结合电荷守恒可知c(CH3COO-)>c(Na+),则溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.氯化铵是强酸弱碱盐,铵根离子在水溶液中存在水解平衡,水解方程式为NH4++2D2O?NH3•HDO+D3O+,所以产生的一水合氨和水合氢离子为NH3•HDO和D3O+,故C错误;
D.根据碳酸钠溶液中的质子守恒可得:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒、质子守恒在判断离子浓度大小中的应用方法.

 名校课堂系列答案
名校课堂系列答案| A. | 同位素:O2和O3 | B. | 同分异构体: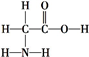 和 和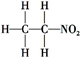 | ||
| C. | 同素异形体:K2O、K2O2、KO2 | D. | 同种物质: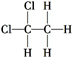 和 和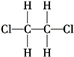 |
| A. | X、Y、Z的浓度不再发生变化 | |
| B. | X、Y、Z三种物质体积分数均相等 | |
| C. | 气体总质量保持不变 | |
| D. | 单位时间消耗3molY,同时生成2molZ |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:2Al-6e-═2Al3+;
总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
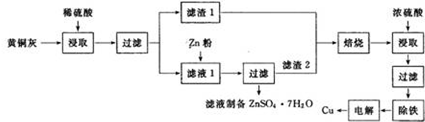 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.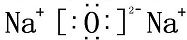 NaOH
NaOH Na2O2
Na2O2
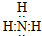 CO2
CO2 HClO
HClO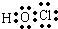 .
.