16.下列各装置能够达到相应实验目的是( )
| A. | 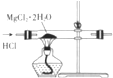 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 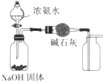 制取并收集干燥纯净的NH3 | D. | 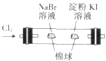 证明氧化性:Cl2>Br2>I2 |
15.化学反应中,有时存在“一种反应物过量,另一种反应物仍然不能完全反应”的特殊情况,下列反应中属于这种情况的是( )
①加热条件下,过量的Mg与浓硫酸充分反应
②4molH2与1molN2在一定条件下充分反应
③在加热条件下,过量的MnO2与浓盐酸充分反应
④在加热条件下,过量的Cu与浓硫酸充分反应
⑤过量的Ag与浓硝酸充分反应
⑥过量的稀硫酸与块状石灰石反应
⑦过量的Cl2与NaBr溶液反应.
①加热条件下,过量的Mg与浓硫酸充分反应
②4molH2与1molN2在一定条件下充分反应
③在加热条件下,过量的MnO2与浓盐酸充分反应
④在加热条件下,过量的Cu与浓硫酸充分反应
⑤过量的Ag与浓硝酸充分反应
⑥过量的稀硫酸与块状石灰石反应
⑦过量的Cl2与NaBr溶液反应.
| A. | ②③④⑥ | B. | ②③⑤⑦ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
14.下列有关有机物的叙述不正确的是( )
| A. | C4H8O2的酯有4种结构 | B. | 异丁烷的一氯代物有2种 | ||
| C. | 甲苯的一氯代物有4种 | D. | 纤维素在人体内可水解成葡萄糖 |
13.化学在生产和生活中有重要的应用,下列说法不正确的是( )
| A. | 可溶性铁盐、铝盐均可用于水的净化 | |
| B. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 | |
| C. | 电解NaCl溶液可制得金属钠 | |
| D. | 在海轮外壳上镶嵌上锌块,可减缓船体的腐蚀速率 |
12.下列各组数据中比值不为1:1的是( )
| A. | 100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 | |
| B. | 常温下,pH=1的HF溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | 常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
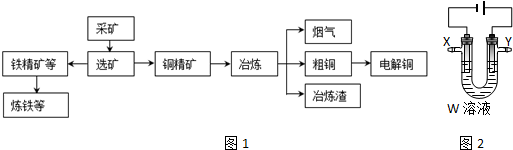
9.某化工厂冶炼金属、回收硫的工艺流程如下:
I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.
然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示.
下列说法不正确的是BC.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液都可以作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
铜盐溶液中Fe2+,Zn2+对精炼铜可能会产生影响.工业上,除去Fe2+方法是氧化沉淀法,在酸性混合溶液中加入双氧水(选填:双氧水、次氯酸钠、氯水或高锰酸钾溶液)将Fe2+氧化成Fe3+,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.加入碱调节溶液pH范围为3.7<pH<4.6.
Ⅲ.冶炼铁
(5)化工厂利用菱铁矿(主要成分是碳酸亚铁)冶炼铁的原理是(用化学方程式表示):FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.生铁炼钢的主要原理是高温下,用氧化剂降低生铁中碳等杂质含量.
(6)生铁在湿润空气中发生电化学腐蚀最终生成红色铁锈,金属电化腐蚀类型为吸氧腐蚀.

I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.
然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示.
下列说法不正确的是BC.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液都可以作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
Ⅲ.冶炼铁
(5)化工厂利用菱铁矿(主要成分是碳酸亚铁)冶炼铁的原理是(用化学方程式表示):FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.生铁炼钢的主要原理是高温下,用氧化剂降低生铁中碳等杂质含量.
(6)生铁在湿润空气中发生电化学腐蚀最终生成红色铁锈,金属电化腐蚀类型为吸氧腐蚀.
8.碳及其化合物有广泛应用.
(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
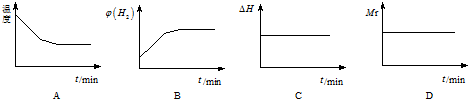
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
相对实验I,实验II可能改变的条件可能是,该温度下,平衡常数=1.
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)
(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)

7.下列分子或离子在指定的分散系中能大量共存的一组是( )
0 167635 167643 167649 167653 167659 167661 167665 167671 167673 167679 167685 167689 167691 167695 167701 167703 167709 167713 167715 167719 167721 167725 167727 167729 167730 167731 167733 167734 167735 167737 167739 167743 167745 167749 167751 167755 167761 167763 167769 167773 167775 167779 167785 167791 167793 167799 167803 167805 167811 167815 167821 167829 203614
| A. | 饱和氯水中:Na+、K+、Cl-、CO32- | |
| B. | 淀粉溶液中:K+、NH4+、SO42-、I- | |
| C. | Na2SiO3溶液中:Cl-、I-、K+、CO2 | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
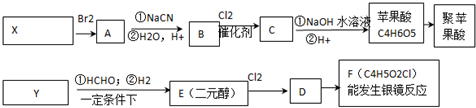
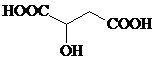 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$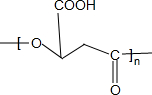 +nH2O;
+nH2O;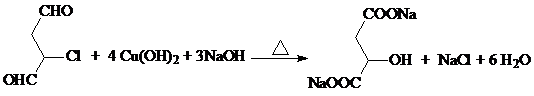 +2Cu2O↓.
+2Cu2O↓.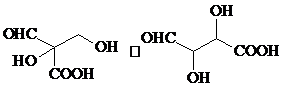 .
.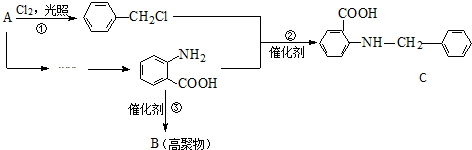
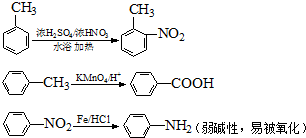
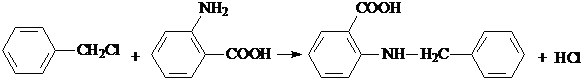 .
.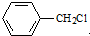 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: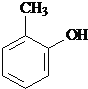 、
、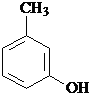 、
、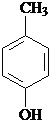 .
.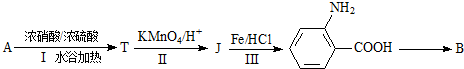
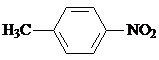 .
.