题目内容
12.下列各组数据中比值不为1:1的是( )| A. | 100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 | |
| B. | 常温下,pH=1的HF溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | 常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
分析 A、在纯水中氢离子的浓度与氢氧根离子的浓度相等;
B、pH=1的HF溶液氢离子的浓度为0.1mol•L-1;
C、根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),结合PH=7分析解答;
D、c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$结合化学式中氢氧根离子和化学式的关系分析.
解答 解:A、在纯水中氢离子的浓度与氢氧根离子的浓度相等,所以c(OH-)与c(H+)之比为1:1,故A正确;
B、pH=1的HF溶液氢离子的浓度为0.1mol•L-1,而盐酸是一元强酸酸的浓度等于氢离子的浓度,所以两者氢离子的浓度相等,故B正确;
C、根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),PH=7说明溶液中c(OH-)=c(H+),所以c(CH3COO-)=c(Na+),故C正确;
D、根据c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$知,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中氢氧根离子浓度相等为0.01mol/L,但溶质的物质的量浓度之比=0.005mol/L:0.01mol/L=1:2,故D错误;
故选D.
点评 本题考查了pH的有关计算,明确弱电解质的电离特点是解本题关键,学生要清楚纯水中,氢离子的浓度等于氢氧根离子的浓度,为易错点.

练习册系列答案
相关题目
3.如图是一个氢核磁共振谱,请你观察图谱,分析其可能是下列物质中( )


| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2OH | C. | 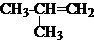 | D. | 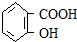 |
20.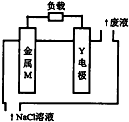 锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )
锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )
 锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )
锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )| A. | 该电池工作时,电子沿M→电解液→Y电极流动 | |
| B. | 若M为铝,则该电池工作时溶液的pH将不断增大 | |
| C. | 若M为镁,则该电池反应的化学方程式为2Mg+O2=2MgO | |
| D. | 若M为铁,则该电池工作时负极发生的反应为Fe-2e-=Fe2+ |
7.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 饱和氯水中:Na+、K+、Cl-、CO32- | |
| B. | 淀粉溶液中:K+、NH4+、SO42-、I- | |
| C. | Na2SiO3溶液中:Cl-、I-、K+、CO2 | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
17.25℃时,下列溶液的离子浓度关系式正确的是( )
| A. | pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1 | |
| B. | 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>② | |
| C. | 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 将amol•L-1CH3COOH与bmol•L-1NaOH溶液等体积混合,测得溶液pH为7,则a>b |
4.新闻:美国《科学》杂志12月17日评选出2004十大科学突破中,有多项与水有关,其中之一是关于对水的研究有新进展,一些科学家对于水分子如何聚合以及电子及质子如何在水中溶解等问题上,都有了新发现.另据 2004年4月14日中科院网报道,中科院物理所王恩哥小组他们首次证明存在一种稳定的二维冰相.它是由四角形和八角形的氢键网格交替组成的,研究人员把这种新的冰结构命名为镶嵌冰.有趣的是,这种镶嵌冰可以在室温下稳定存在.有关这种镶嵌冰的推测肯定不正确的( )
| A. | 镶嵌冰密度不可能比4℃水大 | |
| B. | 镶嵌冰中四角形环比八角形环中水分间的氢键键能强 | |
| C. | 每个水分子形成两个氢键 | |
| D. | 镶嵌冰属于分子晶体 |
1.如表所示的五种元素W、X、Y、T、Z均为短周期元素,且这五种元素的原子最外层电子数之和为26.下列说法正确的是( )
| W | X | Y | |
| T | Z | ||
| M |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质TY2、WZ4在通常情况下状态相同 | |
| D. | M元素的单质具有半导体的特性,M与Z元素可形成化合物MZ4 |
2.下列装置或操作能达到实验目的是( )
| A. |  实验室制取并收集NH3 | B. | 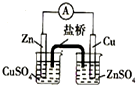 构成原电池 | ||
| C. | 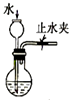 检查装置气密性 | D. |  利用排空气法收集CO2 |
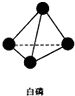 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA