题目内容
8.碳及其化合物有广泛应用.(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
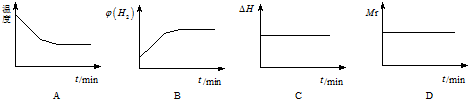
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)
分析 (1)电解铝,阳极发生氧化反应生成氧气,生成的氧气在高温下氧化石墨电极;
(2)①酸性介质中,CO被氧化生成二氧化碳;
②计算1Kg甲醇输出的电能,结合能量密度公式:能量密度=电池输出电能/燃料质量,1kW•h=3.6×106J,一个电子的电量=1.6×10-19C计算;
(3)n(KOH)=0.075L×4mol•L-1=0.3mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,因为二者按3:2恰好反应,据此书写反应的离子方程式;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,据此判断离子浓度大小;
③因为amol•L-1KHCO3溶液的pH=8,所以pH=10-6mol/L,HCO3-+H2O?H2CO3+OH-,c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以根据K=$\frac{c(H{\;}_{2}CO{\;}_{3})c(OH{\;}^{-})}{c(HCO{\;}_{3}{\;}^{-})}$计算;
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(5)①从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,则增大压强,平衡不移动,或者加入催化剂也能加快反应速率,平衡不移动;
等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,根据K=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$计算;
②A、开始投入二氧化碳和氢气,从逆方向进行反应,反应吸热,开始温度下降,当温度不变时达到平衡状态;
B、开始投入二氧化碳和氢气,从逆方向进行反应,氢气体积分数由最大逐渐减小.
C、反应热只与化学计量数有关,与反应限度无关.
D、因为总质量不变,总物质的量也不变,根据混合气体平均相对分子质量=$\frac{m(总)}{n(总)}$判断.
解答 解:(1)电解铝,阳极发生氧化反应生成氧气,电极反应式为2O2--4e-=O2↑,生成的氧气在高温下氧化石墨电极,发生的反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO),故答案为:2O2--4e-=O2↑,C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO);
(2)①在酸性介质中CO氧化生成CO2,负极反应式为CO-2e-+H2O=CO2+2H+,故答案为:CO-2e-+H2O=CO2+2H+;
②1KgCO输出的电能:w=UIt=Uq=1.50×$\frac{1000}{28}$×2×6.02×1023×1.602×10-19J
=1.033×107 J
所以E=$\frac{1.033×10{\;}^{7}}{3.6×10{\;}^{6}}$=2.87 kW•h
故答案为:2.87 kW•h•kg-1;
(3)n(KOH)=0.075L×4mol•L-1=0.3mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,因为二者恰好反应,则反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O,故答案为:2CO2+3OH-=CO32-+HCO3-+H2O;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,所以离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③因为amol•L-1KHCO3溶液的pH=8,所以pH=10-6mol/L,HCO3-+H2O?H2CO3+OH-
c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以K=$\frac{c(H{\;}_{2}CO{\;}_{3})c(OH{\;}^{-})}{c(HCO{\;}_{3}{\;}^{-})}$=$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$,故答案为:$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)
△H=-571.6kJ•mol-1-566.0kJ•mol-1×$\frac{1}{2}$+90.8kJ•mol-1=-763.8kJ•mol-1,故答案为:-763.8kJ•mol-1;
(5)①从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,且反应物和产物都是气态,增大压强,平衡不移动,能缩短达到平衡的时间;加入催化剂也能加快反应速率,缩短达到平衡时间;
等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,所以K=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$=$\frac{0.5mol×0.5mol}{0.5mol×0.5mol}$=1,故答案为:增大压强(或缩小体积)、加催化剂;1;
②A、开始投入二氧化碳和氢气,从逆方向进行反应,反应吸热,开始温度下降,当温度不变时达到平衡状态,故A正确;
B、开始投入二氧化碳和氢气,从逆方向进行反应,氢气体积分数由最大逐渐减小,故B错误.
C、反应热只与化学计量数有关,与反应限度无关,所以焓变一直不变,故C错误.
D、因为总质量不变,总物质的量也不变,所以混合气体平均相对分子质量=$\frac{m(总)}{n(总)}$始终不变,故D错误.
故选:A.
点评 本题考查化学平衡的标志、平衡常数的计算及化学平衡移动原理、盖斯定律的计算应用、离子浓度大小的比较、电解池反应原理及电极反应式的书写,知识点较多,综合性很强,难度较大.

| A. | 氯气通入等物质的量溴化亚铁溶液中:2Cl2+2Fe2++2 Br-=4 Cl-+2Fe3++Br2 | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: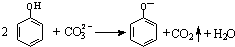 | |
| C. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O=2HCO3- | |
| D. | 氨水吸收过量的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O |
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 人造黄油里的反式脂肪酸对健康不利,它是液态植物油加氢时产生的 | |
| D. | 新制的氢氧化铜可以检验病人是否患有糖尿病 |
| A. | 6种 | B. | 18种 | C. | 24种 | D. | 48种 |
| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
| A. | 可溶性铁盐、铝盐均可用于水的净化 | |
| B. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 | |
| C. | 电解NaCl溶液可制得金属钠 | |
| D. | 在海轮外壳上镶嵌上锌块,可减缓船体的腐蚀速率 |
| 相关实验 | 预期目的 | |
| A | 将SO2通入溴水,溴水褪色 | 验证SO2的还原性 |
| B | 将氯水加入淀粉KI溶液中 | 验证Cl非金属性比I强 |
| C | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| D | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在溶剂中提高苯的比例,能提高溶液的导电性 | |
| B. | 电解时阳极的电极反应式为2Br--2e-=Br2 | |
| C. | 电解时可用铁作阳极材料 | |
| D. | 汽油样品应加在阴极区 |
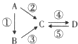 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.