题目内容
16.下列各装置能够达到相应实验目的是( )| A. | 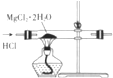 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 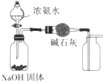 制取并收集干燥纯净的NH3 | D. | 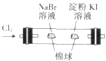 证明氧化性:Cl2>Br2>I2 |
分析 A.制取无水MgCl2应防止水解;
B.气体进入方向错误;
C.应用向下排空法收集氨气;
D.不能排除氯气的影响.
解答 解:A.在氯化氢气流中加热氯化镁晶体,能抑制氯化镁水解,可制得无水MgCl2,故A正确;
B.气体应长进短出,气体进入方向错误,故B错误;
C.氨气密度比空气小,应用向下排空法收集氨气,故C错误;
D.只能证明氯气的氧化性大于溴、碘,不能证明溴的氧化性大于碘,因不能排出氯气的影响,故D错误.
故选A.
点评 本题考查了实验方案评价,为高考常见题型,明确实验原理是解本题关键,根据物质的性质结合实验装置来分析解答,答题时注意把握实验的严密性和可行性的评价,把握实验的操作原理和方法,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目
6.室温下,下列溶液中粒子浓度大小关系正确的是( )
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| C. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 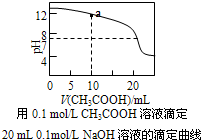 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
7.下列有关检验与鉴别说法正确的是( )
| A. | 用新制氢氧化铜悬浊液能鉴别葡萄糖、甘油、乙醛、乙酸 | |
| B. | 用酸性高锰酸钾即可检验CH2=CHCHO中的碳碳双键 | |
| C. | 为检验氯乙烷中的氯元素,在水解液中滴加稀硫酸酸化,再滴入AgNO3溶液,产生白色沉淀 | |
| D. | 用溴水即可鉴别溴苯、苯、己烯与苯酚 |
4.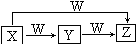 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )| A. | 若X为HNO3,则W可能为Fe | |
| B. | 若W为O2,X可能是S | |
| C. | 若W为O2,则Z可能为NO | |
| D. | X→Z的离子反应可能为Al3++4OH-=AlO2-+2H2O |
1. 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
(1)A原子的最外层电子排布式为3s23p4,D原子共有14种不同运动状态的电子,F的离子的价层电子轨道示意图为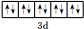 .
.
(2)C与D元素第一电离能的大小关系:Si>Al(填元素符号);
(3)A、B两元素的氢化的分子中键能较小的是H2S(填分子式,下同),分子较稳定的是HCl;
(4)C的单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)A的氢化物分子中的中心原子的杂化方式为sp3,F的离子可与氨分子形成[F(NH3)4]2+,该阳离子中存在的化学键类型有共价键和配位键;
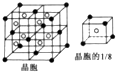
(6)E与钙可组成离子化合物,其晶细胞结构如图所示,该化合物的电子式为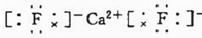 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
 .
.(2)C与D元素第一电离能的大小关系:Si>Al(填元素符号);
(3)A、B两元素的氢化的分子中键能较小的是H2S(填分子式,下同),分子较稳定的是HCl;
(4)C的单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)A的氢化物分子中的中心原子的杂化方式为sp3,F的离子可与氨分子形成[F(NH3)4]2+,该阳离子中存在的化学键类型有共价键和配位键;
(6)E与钙可组成离子化合物,其晶细胞结构如图所示,该化合物的电子式为
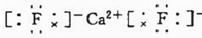 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
8.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合.下列关于C3N4晶体说法错误的是( )
| A. | 该晶体属于原子晶体,其化学键比金刚石更牢固 | |
| B. | 该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 | |
| C. | 该晶体中碳原子和氮原子的最外层都满足8电子结构 | |
| D. | 该晶体与金刚石相似,原子间都是非极性键 |
5.相同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件下的最佳组合是( )
①纯锌片
②粗锌粒
③0.1mol•L-1硫酸
④98%的浓硫酸
⑤加热
⑥用冰水冷却.
①纯锌片
②粗锌粒
③0.1mol•L-1硫酸
④98%的浓硫酸
⑤加热
⑥用冰水冷却.
| A. | ①④⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
6.有关下列两种溶液的说法中,不正确的是( )
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
| A. | 相同温度下,溶液中水的电离程度:①>② | |
| B. | 向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 | |
| C. | 等体积混合溶液①和溶液②,所得溶液中2c(SO42-)=c(Na+) | |
| D. | 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(CH3COO-)+c(SO42-) |
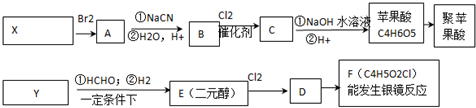
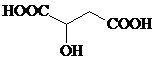 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$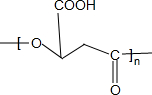 +nH2O;
+nH2O;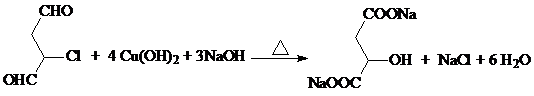 +2Cu2O↓.
+2Cu2O↓.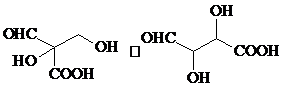 .
.