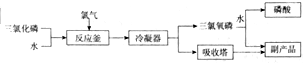
17.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
16.下列说法正确的是( )
| A. | C5H12的同分异构体数目与甲苯(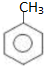 )一氯代物的数目相同 )一氯代物的数目相同 | |
| B. | CH2═CH2+H20$\stackrel{一定条件}{→}$ CH3CH2OH 属于还原反应 | |
| C. | C3H6Cl2有4种同分异构体(不考虑立体异构) | |
| D. | 石油分馏和煤的干馏均属于物理变化 |
15.下列说法正确的是( )
| A. | 电解、电镀、电化学腐蚀都需要通电才可进行 | |
| B. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| C. | 浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 | |
| D. | 氢氧化铝可以中和过多的胃酸 |
11.分子式为C9H10O的芳香族化合物中能发生银镜反应的同分异构体(不考虑立体异构)种数有( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
10.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之积与L层的电子数相同.则下列判断不正确的是( )
0 167482 167490 167496 167500 167506 167508 167512 167518 167520 167526 167532 167536 167538 167542 167548 167550 167556 167560 167562 167566 167568 167572 167574 167576 167577 167578 167580 167581 167582 167584 167586 167590 167592 167596 167598 167602 167608 167610 167616 167620 167622 167626 167632 167638 167640 167646 167650 167652 167658 167662 167668 167676 203614
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序:甲>丙 | |
| C. | 原子半径由大到小的顺序:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
 ,其工业合成路线如下:
,其工业合成路线如下: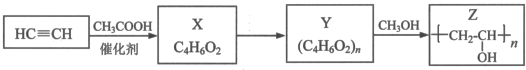
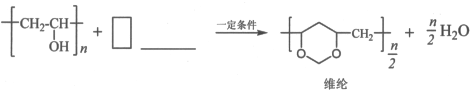
 ;
;
 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下: